
| A、NH4+ |
| B、Fe2+ |
| C、Ag+ |
| D、Al3+ |


科目:高中化学 来源: 题型:
| A、常温常压下,22.4LNO2含有2NA 个氧原子 |
| B、0.1mol?L-1的NaNO3溶液中含有0.1NA 个NO3- |
| C、常温下,34gNH3含有6NA 个N-H共价键 |
| D、1mol Fe2+与足量的Cl2反应,转移2NA 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
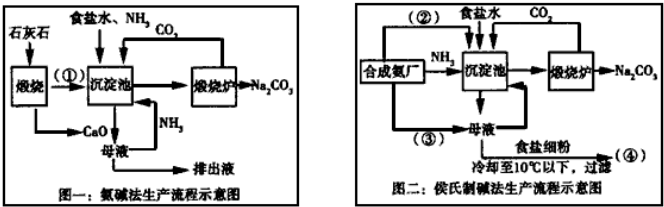
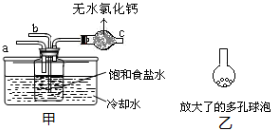
查看答案和解析>>
科目:高中化学 来源: 题型:
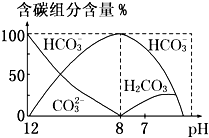 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COOH) |
| c(CH3COO-) |
c(HC
| ||
c(C
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、448mL |
| B、672mL |
| C、896mL |
| D、224mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
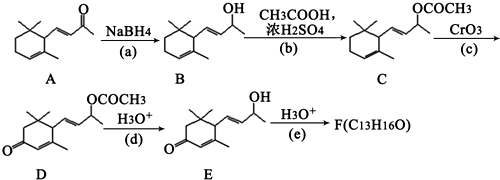
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol?L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.12L氧气 |
| B、1.12L氢气 |
| C、2.24L氢气 |
| D、2.24L氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com