
 H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.02mol氯气时同时生成0.04mol氢氧化钠,则氢氧化钠的物质的量浓度=0.04mol÷0.4L=0.1mol/L,则溶液中氢离子浓度=10?14/0.1
H2↑+Cl2↑+2NaOH,根据氯气和氢氧化钠的关系式知,生成0.02mol氯气时同时生成0.04mol氢氧化钠,则氢氧化钠的物质的量浓度=0.04mol÷0.4L=0.1mol/L,则溶液中氢离子浓度=10?14/0.1

科目:高中化学 来源:不详 题型:填空题
| 物质 | NaCl | K | Na | KCl |
| 熔点/℃ | 770 | 63.65 | 97.5 | 801 |
| 沸点/℃ | 1500(升华) | 774 | 882.9 | 1413 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
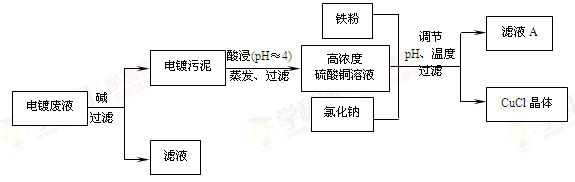
查看答案和解析>>
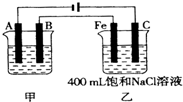
科目:高中化学 来源:不详 题型:单选题
| A.1mol/L | B.2mol/L | C.2.5mol/L | D.3mol/L |
查看答案和解析>>
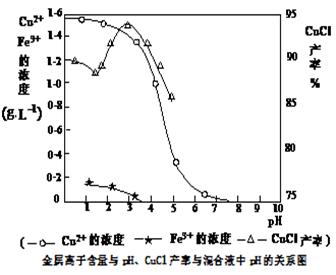
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
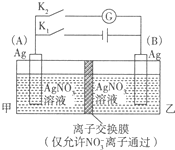
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。 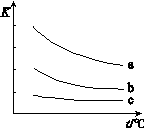

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
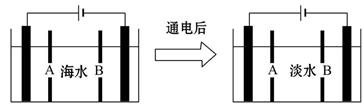
科目:高中化学 来源:不详 题型:单选题
 4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融 氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是
4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融 氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是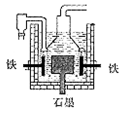
| A.电解熔融氢氧化钠制钠,阴极发生电极反应为:Na++e-=Na |
| B.盖·吕萨克法制钠原理是嫡的增加带动了反应的进行 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为1:1 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com