
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | “神舟十号”宇宙飞船返回舱外表面主要是导电导热良好的新型金属材料钛合金 | |
| C. | “天宫一号”是中国第一个空间实验室,其太阳能电池板的主要材料是硅 | |
| D. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
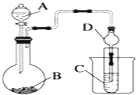 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后变为蓝色沉淀 | Cu(OH)2的Ksp比Mg(OH)2的小 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| C | 向盛Na2SiO3 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| D | 向蔗糖中加入浓硫酸 | 蔗糖变成疏松多孔的海绵状碳 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
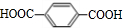 +2NaHCO3→
+2NaHCO3→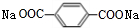 +2H2O+2CO2↑.
+2H2O+2CO2↑.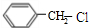 .
.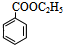 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$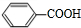 +CH3CH2OH.
+CH3CH2OH.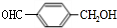 ,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n
,F与氢气1:1加成的芳香产物G中有3种氢,G与B发生聚合反应的化学方程式是n +n
+n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$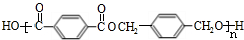 +(2n-1)H2O.
+(2n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
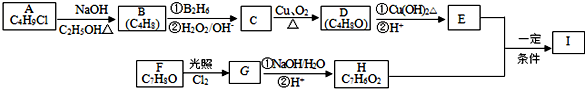
 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ | |
| C. | 反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L•min) | |
| D. | 反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碳原子数(n) | 6 | 8 | 10 | 12 | … |
| 结构简式 | 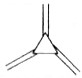 | 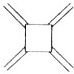 | 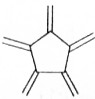 | 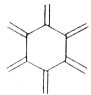 | … |
| A. | 轴烯的通式可表示为CnHn | |
| B. | n=100的轴烯分子中含有50个碳碳双键 | |
| C. | n=6的轴烯分子的同分异构体中含有两个碳碳三键的结构有6种 | |
| D. | n=8的轴烯分子的同分异构体可能属于芳香烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com