
����Ŀ��a.ij�л���A��ѧʽΪCxHyOz��15 gA��ȫȼ������22 gCO2��9 gH2O����ȷ����
��1�����л�������ʽ______________��
��2����A����Է�������Ϊ60�Һ�Na2CO3���������ų���A�ʹ��ܷ���������Ӧ����A�Ľṹ��ʽΪ _______________ ��
��3����A����Է�������Ϊ60�����ӷ���ˮ����ζ��Һ�壬�ܷ���ˮ�ⷴӦ������ṹ��ʽΪ______________��
��4����A���ӽṹ�к���6��̼ԭ�ӣ����ж�Ԫ����ȩ�����ʣ�����ṹ��ʽΪ_______��
b.�л���A��B��C��D��һ������������ͼ��ʾ��ת����ϵ��
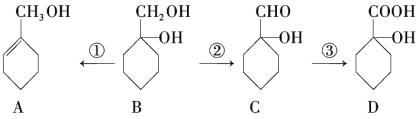
��ش������й����⣺
��1��д��B�ķ���ʽ��____________________��
��2���ֱ�д����Ӧ���ķ�Ӧ����ʽ______________�����ķ�Ӧ����ʽ________________________
��3�����ķ�Ӧ����Ϊ___________________________��
��4��������D��Ũ������ڵ������¼��ȿ��Է���������������Ӧ����E��F����E����Է���������F��С����E��F�Ľṹ��ʽ�ֱ�Ϊ___________________��_________________��
��5�����й����л���A��˵����ȷ����__________________(�����)��
a���������������ӣ����м���
b���ܷ����Ӿ۷�Ӧ
c����ʹ��ˮ��ɫ
d����һ����������������ᷴӦ
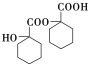
���𰸡� CH2O CH3COOH HCOOCH3 ![]() C7H14O2
C7H14O2 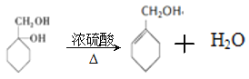
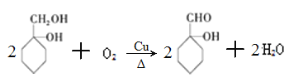 ������Ӧ
������Ӧ 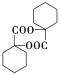
 bcd
bcd
��������a�����ݶ�����̼��ˮ��������������غ㶨�ɼ�����ԭ�ӵ�����������ԭ���غ�������ʽ�������л���ķ���ʽ����仯ѧ�����жϽṹ��ʽ��
b��A�����к���̼̼˫���ʹ��ǻ���B�����к��д��ǻ���C�����к��д��ǻ���ȩ����D�����к����Ȼ��ʹ��ǻ�����Ϲ����ŵ����ʡ�ת����ϵ���
a����1��22 gCO2��9 gH2O�����ʵ����ֱ���22g��44g/mol��0.5mol��9g��18g/mol��0.5mol����˸��������غ㶨�ɿ�֪15gA����ԭ�ӵ�������15g��0.5mol��12g/mol��0.5mol��2��1g/mol��8g�����ʵ�����8g��16g/mol��0.5mol�����x��y��z��1��2��1�����Ը��л�������ʽΪCH2O��
��2����A����Է�������Ϊ60������60/30=2�����Է���ʽΪC2H4O2����Na2CO3��Ϸ�Ӧ������ų��������Ȼ���A�����ᣬA�Ľṹ��ʽΪCH3COOH��
��3����A����Է�������Ϊ60������60/30=2�����Է���ʽΪC2H4O2��A���ӷ���ˮ����ζ��Һ�壬�ܷ���ˮ�ⷴӦ��A�Ǽ����������ṹ��ʽΪHCOOCH3��
��4����A���ӽṹ�к���6��̼ԭ�ӣ�����ʽΪC6H12O6�����ж�Ԫ����ȩ�����ʣ���A������������ṹ��ʽΪHOCH2(CHOH)4CHO��
b����1������B�Ľṹ��ʽ��֪B�ķ���ʽΪC7H14O2��
��2����Ӧ���Ǵ��ǻ�����ȥ��Ӧ����Ӧ�ķ���ʽΪ �����Ǵ��ǻ��Ĵ���������Ӧ�ķ���ʽΪ
�����Ǵ��ǻ��Ĵ���������Ӧ�ķ���ʽΪ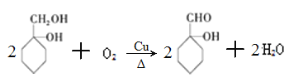 ��
��
��3����Ӧ����ȩ����������Ӧ��
��4��D�����к����ǻ����Ȼ���2����D���Է���������������Ӧ������E����Է���������F��С����˵���ֱ���ȥ2����ˮ��1����ˮ����E��F�Ľṹ��ʽ�ֱ�Ϊ ��
�� ��
��
��5��a�������ǻ�����������a����b������̼̼˫�����ܷ����Ӿ۷�Ӧ��b��ȷ��c������̼̼˫������ʹ��ˮ��ɫ��c��ȷ��d������ȩ������һ����������������ᷢ��������Ӧ��d��ȷ����ѡbcd��


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���淴Ӧ�ڲ�ͬ��Ӧʱ������ʵ����ʵ����ı仯�������ͼ��ʾ��
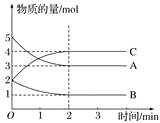
�ش��������⣺
(1)�÷�Ӧ�ķ�Ӧ����________����������________����ѧ����ʽΪ_____________________��
(2)��Ӧ��ʼ��2 minʱ���ܷ���C��Ũ�ȱ仯�����㷴Ӧ���ʣ�Ϊʲô��________________________________________________________________________��
(3)2 min��A��B��C�����ʵ���������ʱ��ı仯���仯��˵������������£���Ӧ�Ѵﵽ��______________״̬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Zԭ������������������WԪ��ԭ�ӵ��������������ڲ��������������X��Zͬ���壬��ԭ�ӵĺ��������֮��Ϊ24��Y��ԭ�Ӱ뾶�����ж���������Ԫ�������ġ�����˵����ȷ���ǣ� ��

A. �����Ӱ뾶��Z��Y��X
B. ��ͼ��ʾʵ���֤���ǽ����ԣ�Cl��Z
C. W��Y��Z�ĵ��ʷֱ���X2��Ӧʱ��X2������ͬ�������ͬ
D. Y�ֱ���X��Z�γɶ�Ԫ�������в����ܴ��ڹ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ı����Ϊ5.1��ƽ��������к�������Ϊ3.67��ƽ�����ռ��������������70.8 %��������һ����Ļ�ѧ��Դ���⣬������ݺ�ˮ��Դ�ۺ����ã���ش��������⣺
��1��������ˮ�ķ�����________________��дһ�ֺ����������ɣ����ɺ�ˮ��ȡ�Ĵ����к���Ca2����Mg2����SO42�������ӣ�Ϊ�˳�ȥ��Щ���ӣ���Ҫ���μ����Թ�����NaOH��BaCl2��________���ѧʽ����֮��________����������ƣ����ټ�������________�����Լ����ƣ�����������Һ����Ũ������ȴ�ᾧ���õ����Ρ�
��2������ˮMgCl2��ȡ����þ�ij��ù�ҵ������__________________��
��3�����±��ͨ��Cl2�û���Br2�����ÿ��������岢��SO2���գ�ת��ΪBr����������Σ��Դﵽ�������Ŀ�ġ��ɺ�ˮ��������еķ�Ӧ�ɵó�Cl����SO2��Br����ԭ����ǿ������˳����__________��
��4����ҵ��Ҳ������Na2CO3��Һ���մ�����Br2�������廯�ƺ������ƣ�ͬʱ�ų�CO2��д����Ӧ�����ӷ���ʽ____________����H2SO4����������Һ���µõ�Br2���䷴Ӧ�����ӷ���ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Y)������Ҫ�Ĺ�����ֵ��������ȿ����ѱ��ٿݽߡ�ͨ������������ʯ���Եõ�Y3+�Ľ���Һ��
��1 ����Һ�ɷ�
Al3+ | Fe3+ | Ca2+ | PO43- | Mg2+ | Mn2+ | Y3+ | |
Ũ��/(mgL-1) | 7670 | 9460 | 550 | 640 | 5600 | 1500 | 70.2 |
��1������Һ�����л��ܼ���HR��������ȡ��ʵ��Y3+�ĸ�������֪��Y3+��Fe3+�������ƣ���ԭ�����£�Fe3+ + 3HR ![]() FeR3 + 3H+ Y3+ + 3HR
FeR3 + 3H+ Y3+ + 3HR ![]() YR3 + 3H+ ����֪��FeR3��YR3��������HR��
YR3 + 3H+ ����֪��FeR3��YR3��������HR��
����Һ�ڲ�ͬpH����ȡ�Ľ����ͼ1��

���û�ѧƽ��ԭ�����ͣ���pH����Y3+��ȡ�������ԭ��________��
�ڽ��ͼ1���ͣ���ҵ����ȡY3+֮ǰ��Ӧ���ȳ�ȥFe3+��ԭ����________��
��2���������кͳ��������������ᷨ�����Գ�����
��2 Fe3+��Y3+ȥ����
�յ�pH | ȥ����/% | |
Fe3+ | Y3+ | |
3.0 | 87.84 | 19.86 |
3.5 | 92.33 | 23.63 |
4.5 | 99.99 | 44.52 |
5.0 | 99.99 | 89.04 |
�кͳ������������Һ�м���NaOH��Fe3+��ȥ�������2��ʾ��
�ٸ�ʵ�������£�Fe3+ȥ���ʱ�Y3+��Ŀ���ԭ��________��
���ᷨ�������ᣨH3PO4����Ԫ���ᣩ���뵽����Һ�У��ټ���Na2CO3��Һ����pHΪ2.5�����˳�ȥ������������FePO4������Һ��ʣ���Fe3+��Y3+Ũ�����3��
��3 ��Һ��Fe3+��Y3+��Ũ��
Fe3+ | Y3+ | |
Ũ��/(mgL-1) | 508 | 68.9 |
�� ��ƽ�����ᷨ�����������е����ӷ���ʽ
Fe3+ + + = FePO4��+ CO2��+ ��___________________
�� �ۺϷ�����1����2����3����ҵ�ϲ��������ᷨ��������ԭ��________��
��3���������ᷨ�����������л��ܼ�HR��ȡY3+����ͨ��________����������ռ���Y3+���л���Һ��
��4���ۺϷ������ϲ��ϣ�����˵����������________��
a. ����ͼ1��֪��pH��0.2��2.0��Χ�ڣ��л��ܼ��е�Fe3+����ˮ��Һ�е�Fe3+
b. ��2�� Y3+��ʧ����20%���ҵ�ԭ����������ɵ�Fe(OH)3��Y3+������
c. ��2�� pH��4.5��5.0��Χ�ڣ�Y3+��ʧ�ʱ��Ŀ���ԭ��Y3+ + 3OH- = Y��OH��3��
d. �л��ܼ���ȡY3+���ŵ���Ca2+��Mg2+��Mn2+�Ƚ���������ȡ�ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�������£���100mL����������NaOH��Һʱ����Һ��pH�仯ͼ����ͼ�����ý�����ȷ���ǣ������� 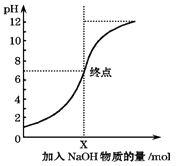
A.ԭ����������ʵ���Ũ��Ϊ0.1mol/L
B.NaOH��Һ��Ũ��Ϊ0.1mol/L
C.pH=1��pH=7�ĵ��Ӧ��Һ��ˮ�ĵ���̶���ͬ
D.X��NaOH��Һ�����Ϊ100mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�м�����������ԭ��Ӧ�����ڷ��ȷ�Ӧ���ǣ� ��
A.��������������ķ�Ӧ
B.̼��������ᷴӦ�ų�������̼
C.þ���ڿ�����ȼ��
D.Ba(OH)2��8H2O��NH4Cl��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ̬����Li-Sb��ؾ��������Ķ����������ԣ�����ԭ����ͼ��ʾ���õ�ص����������Һ���ֳ�3��(����Li��Sb�ɻ���)������˵����ȷ����

A. ��طŵ�ʱLiΪ����
B. ��Li����Na����߸õ�صı�����
C. �õ�س��ʱ��������������������
D. ��Sb�缫�г�����Pb��Ŀ���ǽ��õ�ع����¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���طŵ硢���ķ�ӦʽΪ��Fe+Ni2O3+3H2O ![]() Fe��OH��2+2Ni��OH��2 �� �����ƶ�����ȷ���ǣ������� �ٷŵ�ʱ��FeΪ������Ni2O3Ϊ������
Fe��OH��2+2Ni��OH��2 �� �����ƶ�����ȷ���ǣ������� �ٷŵ�ʱ��FeΪ������Ni2O3Ϊ������
�ڳ��ʱ�������ϵĵ缫��Ӧʽ�ǣ�Fe��OH��2+2e���TFe+2OH����
�۳��ʱ��Ni��OH��2Ϊ�����������صĵ缫�������ij������Һ�У�
A.�٢ڢ�
B.�٢ڢ�
C.�٢ۢ�
D.�ڢۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com