
| A、35.5a V2=w2-w1 | ||
| B、n(Na)=a V2 | ||
C、n(Na)+3n(Al)=
| ||
D、a V2=
|
| ||
| ||
| 1 |
| 2 |
| 3 |
| 2 |
| V1 |
| 22.4 |
| V1 |
| 11.2 |
| V1 |
| 22.4 |
| V1 |
| 11.2 |


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、x=30时,溶液中有Ba2+、Al
| ||||||||||
| B、x=30时,溶液中有Ba2+、Al3+、OH-,且c(OH-)=c(Ba2+) | ||||||||||
C、x=10时,溶液中有N
| ||||||||||
D、x=10时,溶液中有N
|
查看答案和解析>>
科目:高中化学 来源: 题型:
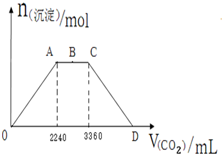 向KOH和Ca(OH)2的混合稀溶液中通入CO2,生成沉淀的物质的量(n)和通入CO2的体积(V)关系如图所示.已知B位于A、C中点.
向KOH和Ca(OH)2的混合稀溶液中通入CO2,生成沉淀的物质的量(n)和通入CO2的体积(V)关系如图所示.已知B位于A、C中点.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 样品的质量/g | NaOH 溶液的体积/ml | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原反应物中CuO与Fe2O3物质的量的比为1:1. |
| B、反应后所得CO2的质量为40g |
| C、参加反应的CO的质量为11.2g |
| D、原反应物中CuO与Fe2O3物质的量的比为1:2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com