
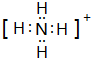 ,E分子的空间构型为三角锥形.
,E分子的空间构型为三角锥形.分析 A+、B+、C-、D、E五种微粒(分子或离子),均含有10个电子,由B++C-→2D,可知B+为H3O+,C-为OH-,D为H2O;由A++C-→D+E,可知A+为NH4+,E为NH3,根据物质的性质和结构解答该题.
解答 解:A+、B+、C-、D、E五种微粒(分子或离子),均含有10个电子,由B++C-→2D,可知B+为H3O+,C-为OH-,D为H2O;由A++C-→D+E,可知A+为NH4+,E为NH3.
①A+为NH4+,电子式为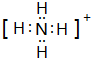 ,E为NH3,分子的空间构型为三角锥形,
,E为NH3,分子的空间构型为三角锥形,
故答案为: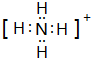 ;三角锥形;
;三角锥形;
②反应NH4++OH-=NH3•H2O,证明结合质子(H+)的能力OH->NH3,反应NH3+H3O+=NH4++H2O证明结合质子(H+)的能力NH3>H2O,可以确定OH-、NH3、H2O结合氢离子的能力为:OH->NH3>H2O,
故答案为:OH->NH3>H2O;NH4++OH-=NH3•H2O、NH3+H3O+=NH4++H2O.
点评 本题考查无机物推断,熟悉掌握10电子微粒是该题的关键所在,侧重考查学生对基础知识熟练掌握程度,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量A,B的转化率增大 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 增大压强,平衡不移动,正、逆反应速率不变 | |
| D. | 加入催化剂,反应速率增大,平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
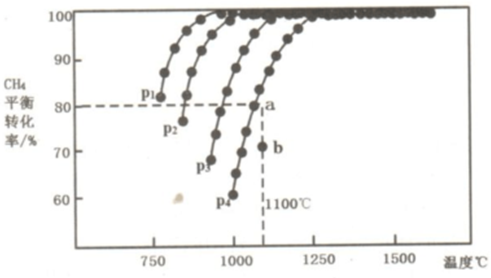
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定没有乙炔 | B. | 混合气体中一定有乙稀 | ||
| C. | 混合气体可能由乙炔和丙烯组成 | D. | 混合气体一定由乙烯和乙炔组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
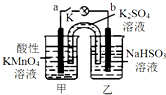 如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
如图所示,装置(两电极都是石墨电极)在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )| A. | 乙烧杯发生的反应:HSO3--2e-+H2O═SO42-+3H+ | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 | |
| D. | 外电路的电子方向是从b到a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10的有机化合物全都能使溴水褪色 | |
| B. | 相同条件下,等质量的碳按a、b 两种途径完全转化,途径a 比途径b 放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2O$→_{燃烧}^{O_{2}}$CO2 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 淀粉和纤维素水解的最终水解产物相同 | |
| D. | 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com