
| A. | 向 H2O中通人 NO2:3NO2+H2O═H++NO3-+2NO | |
| B. | 向Na2SiO3溶液中通入少量SO2:Na2SiO3+SO2+H2O═H2SiO3↓+2Na++SO32- | |
| C. | 用饱和纯減溶液洗涤试管中残留的苯酚:CO32-+2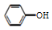 →2 →2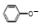 +CO2↑+H2O +CO2↑+H2O | |
| D. | 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ |
分析 A.得失电子不守恒;
B.硅酸钠为可溶性盐,应拆成离子形式;
C.不符合反应客观事实,苯酚与碳酸钠反应生成苯酚钠和碳酸氢钠;
D.NH4Fe(SO4)2和Ba(OH)2按照物质的量之比1:1反应生成硫酸钡、氢氧化铁和硫酸铵.
解答 解:A.向 H2O中通人 NO2,离子方程式:3NO2+H2O═2H++2NO3-+NO,故A错误;
B.向Na2SiO3溶液中通入少量SO2,离子方程式:SiO32-+SO2+H2O═H2SiO3↓+SO32-,故B错误;
C.用饱和纯減溶液洗涤试管中残留的苯酚离子方程式:CO32-+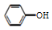 →
→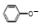 +HCO3-,故C错误;
+HCO3-,故C错误;
D.等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合,离子方程式:2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写注意问题是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,遵循氧化还原反应得失电子守恒规律,注意反应物用量对反应的影响,题目难度中等.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:解答题
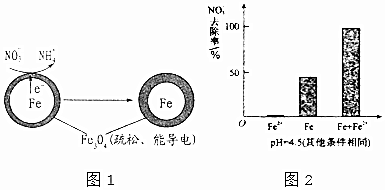
| 初始pH | pH=2.5 | pH=4.5 |
| 1小时pH | 接近中性 | 接近中性 |
| 24小时pHNO3-的去除率 | 接近100% | <50% |
| 铁的最终物质形态 | 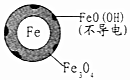 | 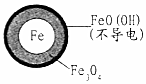 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(Z)>r(W)>r(Y)>r(X) | |
| B. | Y的简单气态氢化物的热稳定性比W的强 | |
| C. | Z3W中既含有离子键又含有共价键 | |
| D. | X的单质不能与Y的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液中,溶液变浑浊 | 酸性:碳酸>苯酚 |
| B | 向1mL 0.1mol•L-1 MgSO4溶液中,滴入2滴0.1mol•L-1 NaOH溶液,产生白色沉淀,再滴入2滴0.1mol•L-1CuSO4溶液,白色沉淀逐渐变为蓝色 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| C | 向蛋白质溶液中加入甲醛溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
| D | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色 | 该溶液是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从海水中可提取镁,电解熔融氯化镁可制得金属镁 | |
| B. | 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生 | |
| C. | 玛瑙、水晶、钻石、红宝石等装饰品的主要成分都是硅酸盐 | |
| D. | 开发二氧化碳制成的全降解塑料,缓解日益严重的“白色污染” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,9.2gNO2气体中.分子数为0.2NA | |
| B. | pH=2的硫酸溶液中,H+数目为0.01NA | |
| C. | 将0.05molFeCl3全部转化为Fe(OH)3胶体,则胶粒数目为0.05NA | |
| D. | 20gD2O中含有的质子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | K37ClO3与浓盐酸在加热条件下生成氯气:37ClO3-+6Cl-+6H+═37Cl-+3Cl2↑+3H2O | |
| D. | 4mol•L-1的NaAlO2溶液与7mol•L-1的盐酸等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| C | KNO3和KOH 混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸 | 试纸变为蓝色 | NO3-还原为NH3 |
| D | 向两份蛋白质溶液中分别滴加Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com