
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4价;②氧化性:Ce4+> Ce3+。下列说法正确的是
A.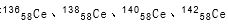 它们互称同素异形体
它们互称同素异形体
B.铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑
C.工业上可以采用电解氯化铈水溶液来获得铈单质
D.工业上金属铈一般保持在敞口容器中
科目:高中化学 来源:2015-2016学年广西桂林中学高二上期中考试文化学试卷(解析版) 题型:选择题
下列说法中正确是( )
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
可检查淀粉部分发生水解的试剂是( )
A.碘水 B.碘化钾溶液
C.硝酸银溶液 D.银氨溶液、碘水
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附中高考适应性月考(四)理综化学试卷(解析版) 题型:选择题
仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是
选项 | 实验目的 | 玻璃仪器 |
A | 分离乙醇和乙酸的混合物 | 分液漏斗、烧杯、玻璃棒 |
B | 用0.10mol/L的盐酸配制100 mL 0.050mol/的盐酸 | 100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
C | 用溴水、淀粉KI溶液比较Br2和I2的氧化性强弱 | 试管、胶头滴管 |
D | 用NH4Cl固体和Ca(OH)2固体制备并收集NH3 | 酒精灯、烧杯、导管、集气瓶 |
查看答案和解析>>
科目:高中化学 来源:2016届四川成都第七中学高三阶段测试三理综化学试卷(解析版) 题型:选择题
下列离子反应方程式书写正确的是( )
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.向NaAlO2溶液中通入过量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3+HCO3-
C.在强碱溶液中次氯酸钠与氢氧化铁反应生成Na2FeO4:
3ClO2-+2Fe(OH)3=2FeO42-+3Cl-+4H+
D.向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-=Al2S3↓
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第五次月考理化学试卷(解析版) 题型:填空题
化合物H可用以下路线合成:
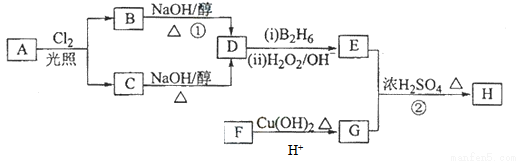
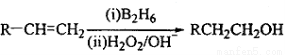
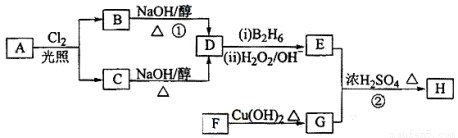 已知:
已知: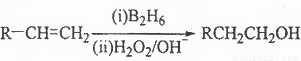
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88gCO2和45gH2O,且A分子结构中有3个甲基,则A的名称(系统命名)为 ;
(2)B和C均为一氯代烃,则反应(1)的反应类型为 ;
(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式 。
(4)反应②的化学方程式为 ;
(5)与G具有相同官能团的芳香类同分异构体共有 种(不包括G),写出其中任意两种_____________、___________。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏回族自治区银川一中高三上第四次月考理化学试卷(解析版) 题型:填空题
X、Y、M、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;M是周期表中电负性最大的元素;Z基态原子的M层是K层电子数的3倍;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)基态Y原子的价电子排布图是______;Z所在周期中第一电离能最大的主族元素是_______(元素名称)
(2)XY2? 离子的立体构型是________;R2+的水合离子[R(H2O)4]2+中,提供孤电子对的原子是________(元素符号)。
(3) 已知XH3易与R2+形成配离子,但XM3不易与R2+形成配离子,其原因是_______________
(4)Y与R所形成的化合物晶体晶胞如右图所示,该晶体的化学式:_____________;晶胞参数如图所示,则该晶胞密度是_______________g·cm-3(列式并计算结果,保留小数点儿后一位)。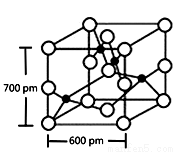
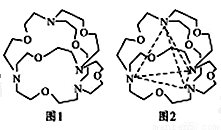
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是________(填标号)。
A.CF4 B.CH4 C.NH4+ D.H2O
查看答案和解析>>
科目:高中化学 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:填空题
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。
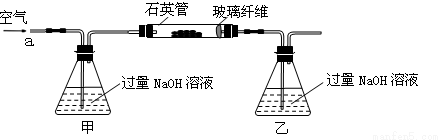
将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2,4FeS + 7O2
2Fe2O3+8SO2,4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
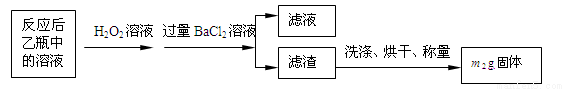
(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________________________________________________________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】:测定铁元素的含量
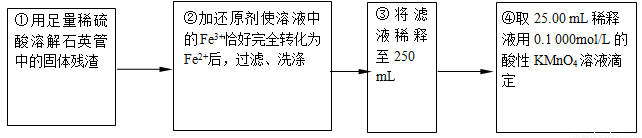
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高二上期中测试化学试卷(解析版) 题型:填空题
电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
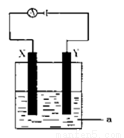
(1)若X、Y依次为铜和铁,a仍为CuSO4溶液,且反应过程中未生成Fe3+,则Y极的电极反应式为
(2)若用此装置电解精炼铜, 做阳极,电解液CuSO4的浓度 (填“增大”、“减小”或“不变”)。
(3)PbO2可以通过石墨为电极,Pb(NO3)2 和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 。
(4)如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
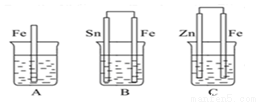
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为 (填字母序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com