
| A. | 在铁质船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率,称为牺牲阴极的阳极保护法 | |
| B. | 电解饱和食盐水是将电能转变成化学能,在阴极附近生成氢氧化钠和氢气 | |
| C. | 铜锌原电池反应中,铜片作正极,产生气泡发生还原反应,电子从铜片流向锌片 | |
| D. | 外加电流的阴极保护法是将被保护的金属与外加电源的正极相连 |
分析 A、原电池负极发生氧化反应,锌比铁活泼,锌作阳极不断被腐蚀;
B、在外加电源的作用下,电解饱和食盐水,阴极上氢离子得电子;
C、原电池中电子从负极流向正极;
D、外加电流的阴极保护法应将被保护的金属应与外加电源的负极相连,作阴极被保护.
解答 解:A、在船体上镶嵌锌块,形成锌铁原电池,锌比铁活泼,锌作负极不断被腐蚀,铁做正极则不会被腐蚀,称为牺牲阳极的阴极保护法,故A错误;
B、在外加电源的作用下,电解饱和食盐水是将电能转变成化学能,阴极上氢离子得电子生成氢气,同时溶液中生成氢氧根离子,故B正确;
C、铜锌原电池反应中,Zn失电子作负极,铜片作正极,产生气泡发生还原反应,电子从锌片流向铜片,故C错误;
D、外加电流的阴极保护法应将被保护的金属与外加电源的负极相连,与正极相连作阳极会失电子被腐蚀,故D错误;
故选B.
点评 本题考查了金属的腐蚀与防护,题目难度中等,注意掌握金属的电化学腐蚀原理,明确金属防护常用的措施及原理,能够正确辩别电化学腐蚀与化学腐蚀的、析氢腐蚀与吸氧腐蚀.


科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、MnO4- | B. | OH-、Ba2+、Cl-、SO42- | ||
| C. | HCO3-、K+、OH-、NO3- | D. | NO3-、SO42-、K+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
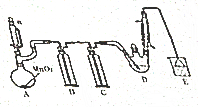 某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:
某探究小组设计如图所示装置(夹持、加热仪器略)、模拟工业生产进行制备氯乙醛(CCl3CHO)的实验,查阅资料,有关信息如图所示:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: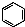 +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$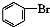 +HBr +HBr | |
| B. | 蛋壳溶于食醋:CaCO3+CH3COOH=CH3COOCa+H2O+CO2↑ | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向氯乙烷水溶液中加入氢氧化钠溶液共热:CH3CH2Cl+NaOH$\stackrel{△}{→}$CH2=CH2+NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1 L 1 mol/L 的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| B. | 制成0.5 L 10 mol/L 的盐酸,需要氯化氢气体 112L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2 溶液中,Ba2+ 和Cl- 总数位3×6.02×1023 | |
| D. | 10 g 98% 硫酸 (密度为 1.84g/cm3)与10 mL 18.4 mol/L 硫酸的浓度是不同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
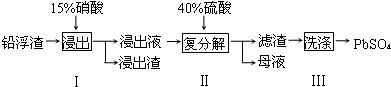
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
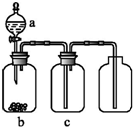 用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )
用如图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),可行的是( )| 气体 | a | b | c | |
| A | CO2 | 稀盐酸 | CaCO3固体 | 浓硫酸 |
| B | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| C | SO2 | 浓硫酸 | 铜片 | 酸性KMnO4溶液 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com