
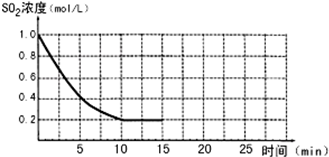
 已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.
已知:2SO2(g)+O2(g)?2SO3(g);△H=-196kJ/mol,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图.| △c |
| △t |
| 2mol-0.8mol |
| 2L |
| 消耗量 |
| 起始量 |
| 0.8mol/L |
| 10min |
| 1 |
| 2 |
| 1 |
| 2 |
| 0.8mol |
| 2mol |
 ;
;


科目:高中化学 来源: 题型:
A、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| B、Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O | ||||
| C、双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | ||||
| D、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
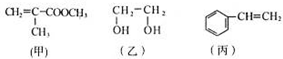 “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.如图甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法中,错误的是( )
“神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料.如图甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料.下列说法中,错误的是( )| A、甲物质可以在引发剂作用下生成有机高分子化合物 |
| B、1mol乙物质可与2mol钠完全反应生成1mol氢气 |
| C、丙物质能够使酸性高锰酸钾溶液退色 |
| D、甲、乙、丙三种物质都可以发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
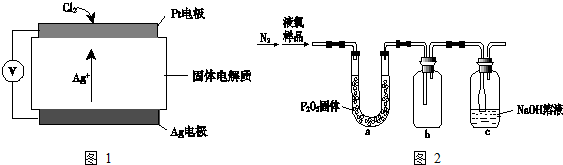
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 装置 | 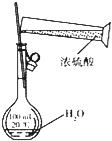 |
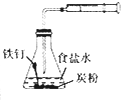 |
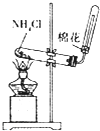 |
 |
| 目的 | 配制稀硫酸 | 探究铁的吸氧腐蚀 | 实验室制备氨气 | 除去乙烯中的乙烷 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
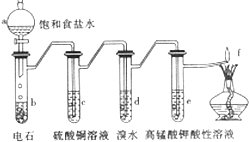 如图是制备和研究乙炔性质的实验装置图.下列说法不正确的是( )
如图是制备和研究乙炔性质的实验装置图.下列说法不正确的是( )| A、制备乙炔的反应原理是:CaC2+2H2O→Ca(OH)2+C2H2↑ |
| B、c的作用是除去影响后续实验的杂质 |
| C、d中的有机产物与AgNO3溶液混合能产生沉淀 |
| D、e中的现象说明乙炔能被高锰酸钾酸性溶液氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
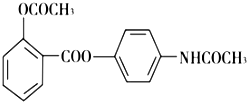 贝诺酯具有抗风湿、解热镇痛作用,其结构简式如图,下列说法正确的是( )
贝诺酯具有抗风湿、解热镇痛作用,其结构简式如图,下列说法正确的是( )| A、贝诺酯可与水任意比互溶 |
| B、贝诺酯完全水解后能得到3种物质 |
| C、1mol贝诺酯最多可与9mol H2发生加成反应 |
| D、贝诺酯可发生取代反应、消去反应和聚合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com