
【题目】已知A,B,C,D,E,F,G七种元素为元素周期表中短周期元素,其原子序数依次增大.A的质量数等于其质子数;B原子的最外层电子数是其电子层数的2倍;D的最外层电子数是其电子层数的3倍;E,F,G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,E,F,G的最外层电子数之和为10.回答下列问题.
(1)元素D、F的名称、;
(2)C元素在周期表中的位置;
(3)用电子式表示D,E两元素形成的1:1的化合物的形成过程其中含有的化学键的类型
(4)写出分别由A,D,E,G四种元素组成的两种化合物反应的化学方程式;
(5)写出E、F的最高价氧化物的水化物反应的离子方程式 .
【答案】
(1)氧;铝
(2)第二周期ⅤA族
(3)![]() ;离子键、共价键
;离子键、共价键
(4)NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑
(5)OH﹣+Al(OH)3=AlO2﹣+2H2O
【解析】解:A、B、C、D、E、F、G七种元素为元素周期表中短周期元素,其原子序数依次增大.A的质量数等于其质子数,说明原子核内无中子,应为H元素;B原子的最外层电子数是其电子层数的2倍,为C元素;D的最外层电子数是其电子层数的3倍,为O元素,则C为N元素;E、F、G三种元素同周期且它们的最高价氧化物的水化物两两反应生成均盐和水,则F为Al,E为Na,E、F、G的最外层电子数之和为10,可知G的最外层电子数为10﹣1﹣3=6,为S元素,(1)由以上分析可知D为氧元素,F为铝元素,所以答案是:氧;铝;(2)C为N元素,位于周期表第二周期ⅤA族,所以答案是:第二周期ⅤA族;(3)D,E两元素形成的1:1的化合物为过氧化钠,为离子化合物,含有离子键和共价键,形成过程为 ![]() ,所以答案是:
,所以答案是: ![]() ;离子键、共价键;(4)由A、D、E、G四种元素组成的两种盐为NaHSO4、NaHSO3 , 二者反应生成二氧化硫和水,反应的化学方程式为NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑,
;离子键、共价键;(4)由A、D、E、G四种元素组成的两种盐为NaHSO4、NaHSO3 , 二者反应生成二氧化硫和水,反应的化学方程式为NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑,
所以答案是:NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑;(5)氢氧化铝具有两性,能与氢氧化钠反应生成偏铝酸钠,离子反应方程式为OH﹣+Al(OH)3=AlO2﹣+2H2O,所以答案是:OH﹣+Al(OH)3=AlO2﹣+2H2O.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后Na2SO3转化为
A.Na2SO4 B.SO2 C.S D.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关金属晶体的判断正确的是
A. 简单立方堆积、配位数6、空间利用率68%
B. 体心立方堆积、配位数6、空间利用率68%
C. 六方最密堆积、配位数8、空间利用率74%
D. 面心立方最密堆积、配位数12、空间利用率74%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下表:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是_______。
(2)在一定温度下,将2molN2和6molH2通入到体积为2L的密闭容器中,发生反应N2+3H2![]() 2NH3,2min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=_______________(结果用最简分数表示);欲使K增大,可以采取的措施是______。
2NH3,2min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=_______________(结果用最简分数表示);欲使K增大,可以采取的措施是______。
(3)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是______(选填序号字母)
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂
(4)NH3能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、金属键、离子键和分子间作用力都是构成物质微粒间的不同相互作用力,含有上述中的三种相互作用力的晶体是( )
A. SiO2晶体 B. CCl4晶体 C. NaCl晶体 D. 石墨晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________________。
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为_____________。(溶液混合前后体积变化可忽略)
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
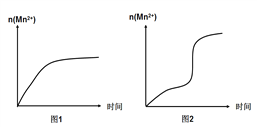
①该小组同学提出的假设是_____________。
②请你帮助该小组同学完成实验方案,并填写表中空白
实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | _____________ | 2.0 | 2.0 | 3.0 | MnSO4 | t |
③若该小组同学提出的假设成立,t_____________1.5(填“大于”、“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一小块钠投入盛有煤油(与水不相溶)和水的烧杯中,可以观察到的现象是
A. 钠浮在烧杯中的液面上 B. 钠沉在烧杯的底部
C. 钠会在水和煤油的交界面上下浮动,直到反应结束 D. 煤油会燃烧起来,产生很浓的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的分散系
① 是溶液 ② 是胶体 ③ 能产生丁达尔效应 ④ 能透过滤纸 ⑤ 不能透过滤纸 ⑥ 静置后会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com