
硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl2 BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼: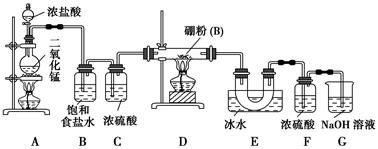
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:_______________________。
(2)E装置的作用是_______________________________________。
如果拆去B装置,可能的后果是_______________________________________
_________________________。
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:______________________________;
实验室保存三氯化硼的注意事项是__________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:
________________________________________________________________。
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:实验题
(12分)氯化钾样品中含有少碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将过滤液按下图所示步骤进行操作。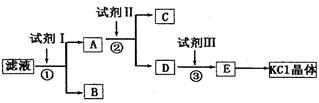
回答下列问题:
(1)起始时滤液的pH_____7(填“大于”“小于”或“等于”),其原因是__________________(用离子方程式表示)。
(2)试剂I的化学式为______,①中发生反应的离子方程式为_____________________。
(3)试剂II的化学式为_____,②中加入试剂II的目的是_________________________。
(4)试剂III的名称是_____,③中发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所示装置(夹持仪器和连接用的胶管已经省略)。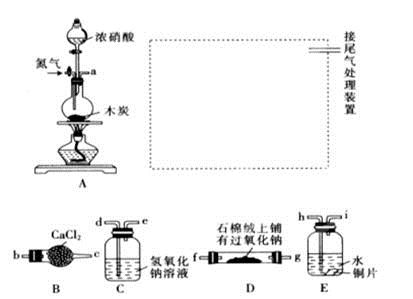
(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为:
a→( )( )→( )( )→( )( )→ ( )( )(填仪器接口的字母编号)。连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通入氮气的主要目的是 。
(2)装置E中观察到的主要实验现象有 。
(3)装置C的作用是 。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解生成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成: 。(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I-氧化为I2,同时生成NO,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铁触媒(铁的氧化物)是合成氨工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列实验方法测定铁触媒的含铁量,确定其组成。
(1)步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2)若通入Cl2不足量,溶液B中还含有 会影响测定结果。
(3) 若通入Cl2过量且加热煮沸不充分,溶液B中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol L-1酸性KMnO4溶液、紫色石蕊试液、淀粉-KI溶液、0.1mol L-1 KSCN溶液、 品红稀溶液
| 实验操作 | 实验现象与结论 |
| 取适量溶液B于试管中,滴加 ,振荡 ,放置一段时间后,观察现象。 | 若溶液 ,则溶液B中含Cl2; 若溶液 ,则溶液B中不含Cl2。 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20% KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
| 沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
| Mg(OH)2 | 9.6 | 11.1 |
| Fe(OH)3 | 2.7 | 3.7 |
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| …… | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(13分)某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验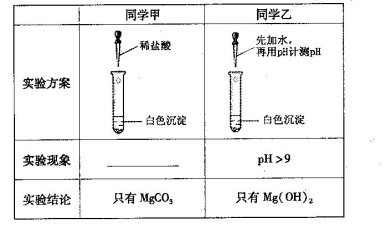
(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。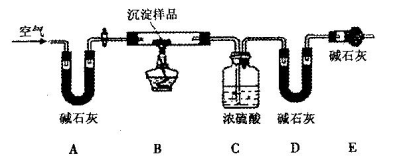
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
三次实验所得数据如下:(部分数据已换算为相应的物质的量)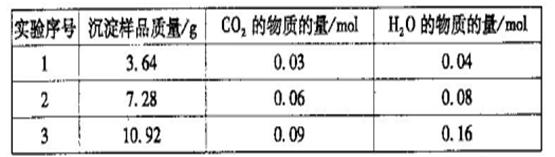
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O d.Mg5(OH)4(CO3)3·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下 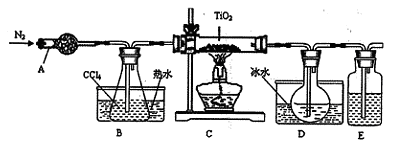
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与 TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图: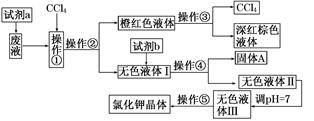
可供选择的试剂:饱和Na2CO3溶液,饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用________。
(2)操作①②③④⑤的名称是________(填序号)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
苯乙醚是一种无色油状液体,熔点-30 ℃,沸点 172 ℃,不溶于水,易溶于醇和醚,广泛用于有机合成中间体及制造医药、染料等。实验合成的原理为:
主要实验步骤如下:
(Ⅰ)合成:在烧瓶中(装置如图)加入7.53 g苯酚、3.92 g NaOH和4 mL水,开动搅拌器,使固体全部溶解,加热反应器控制温度80~90 ℃之间,并用滴液漏斗慢慢滴加8.59 mL溴乙烷(沸点38.4 ℃),大约40 min滴加完毕,继续搅拌1 h,冷却至室温。
(Ⅱ)分离与提纯。
①加入适量的水(10~15 mL)使固体完全溶解,将液体转入分液漏斗中,分出水相;
②水相用8 mL乙醚萃取一次,与有机相合并;
③有机相用等体积饱和食盐水洗两次,分出水相,再将水相用6 mL乙醚萃取一次,与有机相合并;
④有机相用无水氯化钙干燥;
⑤先用水浴蒸出乙醚,然后常压蒸馏,收集148 ℃稳定的馏分得苯乙醚;
⑥称量产品质量3.69 g。
回答下列问题:
(1)用图示的滴液漏斗代替普通漏斗滴液,其优点是_______________________。
(2)合成时,开动搅拌器的目的是_______________________________。
(3)控制温度80~90 ℃可采用的方法是________________,两次用乙醚萃取的目的是________________________________________________________。
(4)蒸馏时最后温度稳定在148 ℃左右,其原因是_________________
_______________________________________________________。
(5)本次产率为12.4%,产率偏低的原因可能有__________________________
______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com