
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
分析 (1)氢氟酸是弱电解质,溶液中存在电离平衡,加水稀释其溶液促进氢氟酸电离,注意水的离子积常数只与温度有关;
(2)A.酸或碱抑制水电离,含有弱根离子的盐促进水电离;
B.根据电荷守恒计算;
C.根据电荷守恒计算;
D.等物质的量的氢氟酸和氢氧化钠恰好反应生成氟化钠,溶液呈碱性,根据电守恒判断,注意等体积混合时,不水解离子浓度变为原来的一半;
(3)等物质的量浓度的钠盐溶液,酸根离子水解程度越大其溶液的pH越大;
(4)CO32-水解生成碳酸氢根离子和氢氧根离子;
(5)多元弱酸的酸式根在水溶液中存两种趋势,电离与水解,如果电离大于水解溶液呈酸性;如果水解大于电离溶液呈碱性,由此分析解答.
解答 解:(1)氢氟酸是弱电解质,溶液中存在电离平衡,加水稀释其溶液促进氢氟酸电离,
A.稀释过程中促进氢氟酸电离,但c(H+)减小,故正确;
B.温度不变,水的离子积常数不变,所以c(H+)•c(OH-)不变,故错误;
C.稀释过程中促进氢氟酸电离,氢离子个数增大,氟化氢分子个数减小,所以$\frac{c({H}^{+})}{c(HF)}$ 增大,故错误;
D.稀释过程中促进氢氟酸电离,氢离子浓度降低,氢氧根离子浓度增大,所以$\frac{c(O{H}^{-})}{c({H}^{+})}$增大,故错误;
故选A;
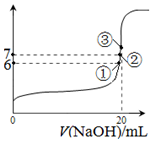
(2)A.氢氟酸抑制水电离,氟化钠促进水电离,所以pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的不相等,故错误;
B.①点时pH=6,溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),所以c(F-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,故正确;
C.②点时,溶液呈中性,c(OH-)=c(H+),溶液中存在电荷守恒,c(F-)+c(OH-)=c(Na+)+c(H+),
所以c(F-)=c(Na+),故正确;
D.③点时V=20mL,此时溶液中溶质在氟化钠,溶液呈碱性,根据电荷守恒知c(F-)<c(Na+),但等体积混合时不水解的离子浓度变为原来的一半,所以c(F-)<c(Na+)=0.05mol/L,故错误;
故选BC;
(3)等物质的量浓度的钠盐溶液,酸根离子水解程度越大其溶液的pH越大,酸的电离常数越小其酸根离子水解程度越大,所以等物质的量浓度的①Na2CO3溶液②NaHCO3溶液③NaF溶液④NaClO溶液中pH由大到小的顺序是:
①④②③,故答案为:①>④>②>③;
(4)CO32-水解生成碳酸氢根离子和氢氧根离子,水解反应的方程式为:Na2CO3+H2O?NaHCO3+NaOH,故答案为:Na2CO3+H2O?NaHCO3+NaOH;
(5)NaHCO3溶液中,碳酸氢根离子的水解程度大于电离程度,所以碳酸氢钠的水溶液呈碱性,故答案为:HCO3-的水解程度大于HCO3-的电离程度.
点评 本题考查较综合,涉及弱电解质的电离、盐类水解、离子浓度大小的比较,电荷守恒在解题中的应用,有一定的难度.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 右边电极上生成物质的质量:①=② | |
| B. | 两级上产生气体的体积:①<② | |
| C. | 溶液的pH变化:①增大,②不变 | |
| D. | 电极反应式:①中阳极2H2O-4e-=4H++O2↑②中负极2H+-2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.
.检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2不溶于水,因此不属于酸性氧化物 | |
| B. | CO2通入水玻璃中可得硅酸,说明碳酸酸性大于硅酸 | |
| C. | SiO2是酸性氧化物,它不溶于任何酸 | |
| D. | SiO2晶体由SiO2分子构成,1个Si原子连接2个O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将稀硫酸改用浓硫酸 | B. | 向稀硫酸中加入少量硫酸铜溶液 | ||
| C. | 向稀硫酸中加入硫酸钠固体 | D. | 给装置中发生反应的部分加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com