
| A. | 金属钠加入无水乙醇中:Na+C2H5OH→C2H5ONa+H2↑ | |
| B. | 过量的乙酸跟Na2CO3溶液反应:2H++CO32-═H2O+CO2↑ | |
| C. | 溴乙烷在NaOH水溶液中加热:CH3CH2Br+NaOH→CH2═CH2↑+NaBr+H2O | |
| D. | 苯酚钠溶液中通入CO2: +CO2+H2O→ +CO2+H2O→ +HCO${\;}_{3}^{-}$ +HCO${\;}_{3}^{-}$ |
分析 A.反应没有配平;
B.乙酸在离子反应中保留化学式;
C.溴乙烷在NaOH水溶液中加热,发生水解反应生成乙醇;
D.反应生成苯酚和碳酸氢钠.
解答 解:A.金属钠加入无水乙醇中的反应为2Na+2C2H5OH→2C2H5ONa+H2↑,故A错误;
B.过量的乙酸跟Na2CO3溶液反应的离子反应为2CH3COOH+CO32-═2CH3COO-+H2O+CO2↑,故B错误;
C.溴乙烷在NaOH水溶液中加热的反应为CH3CH2Br+NaOH$→_{△}^{H_{2}O}$CH3CH2OH+NaBr,故C错误;
D.苯酚钠溶液中通入CO2的离子反应为 +CO2+H2O→
+CO2+H2O→ +HCO3-,故D正确;
+HCO3-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重有机物的结构与性质及离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:填空题

 )
)

 +HOCH2CH2Cl$→_{△}^{浓硫酸}$
+HOCH2CH2Cl$→_{△}^{浓硫酸}$ +H2O
+H2O

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量酒精在空气中挥发不见了;少量酒精在空气中燃烧后消失 | |
| B. | 块状生石灰在空气中逐渐变成粉末;晶体碳酸钠在空气中逐渐变成粉末 | |
| C. | 木炭燃烧发光、发热;电灯发光、发热 | |
| D. | 石灰水中通入少量CO2后变浑浊;室温下的饱和石灰水加热后变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 0.1 mol AgCl和0.1mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-) | |
| C. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| D. | 25℃时,0.1mol•L-1的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 乙醇的结构式为: | |
| C. | 用电子式表示Na2S的形成过程可表示为: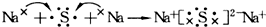 | |
| D. | 丙烷的比例模型为: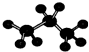 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 溶度积小的沉淀可以转化为溶度积更小的沉淀 | |
| B. | 若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 | |
| C. | 25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 | |
| D. | 25℃时,AgCl固体在等质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7 | B. | c(A-)>c(B+) | ||
| C. | c(OH-)=$\sqrt{{K}_{w}}$ | D. | c(H+)-c(OH-)=c(A-)-c(B+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com