

分析 纯化工业级氧化锌和稀硫酸反应导致溶液中存在Fe2+、Mn2+、Zn2+和Ni2+,向浸出液中加入适量高锰酸钾溶液并调节溶液的pH约为5,Ni(Ⅱ)不能被氧化,Fe2+、Mn2+被氧化而被除去,同时溶液中有MnO2生成,过滤后,向滤液中加入Zn过滤,Zn和Ni2+发生氧化还原反应生成Ni,溶液中存在Zn2+,向滤液中加入碳酸钠溶液,生成碳酸锌沉淀,煅烧碳酸锌沉淀生成ZnO,
(1)根据题意,Ni(Ⅱ)不能被氧化,反应②中除掉的杂质离子是Fe2+和Mn2+,根据MnO4-+具有氧化性,能将Fe2+和Mn2+氧化,根据电子得失进行配平;加高锰酸钾溶液前,若pH较低,铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质.
(2)反应③为锌与镍离子的发生反应得到锌离子和镍;得到的滤渣中,除了过量的锌外还有金属镍.
(3)检验沉淀是否洗涤干净的方法是最后一次洗涤液,检验表面是否含有硫酸根离子;
(4)根据关系式ZnCO3•xZn(OH)2~(x+1)ZnO来计算.
解答 解:纯化工业级氧化锌和稀硫酸反应导致溶液中存在Fe2+、Mn2+、Zn2+和Ni2+,向浸出液中加入适量高锰酸钾溶液并调节溶液的pH约为5,Ni(Ⅱ)不能被氧化,Fe2+、Mn2+被氧化而被除去,同时溶液中有MnO2生成,过滤后,向滤液中加入Zn过滤,Zn和Ni2+发生氧化还原反应生成Ni,溶液中存在Zn2+,向滤液中加入碳酸钠溶液,生成碳酸锌沉淀,煅烧碳酸锌沉淀生成ZnO,
(1)根据题意,Ni(Ⅱ)不能被氧化,反应②中除掉的杂质离子是Fe2+和Mn2+,发生的离子方程式为MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;加高锰酸钾溶液前,若pH较低,铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
故答案为:Fe2+和Mn2+;MnO4-+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+、2MnO4-+3Mn2++2H2O=5MnO2↓+4H+;铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质;
(2)得到的滤渣中,除了过量的锌外还有金属镍,故答案为:锌、镍;
(3)由于溶液中硫酸根离子属于杂质离子,因此可以检验测定洗涤液中是否存在硫酸根离子,操作为:取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,
故答案为:取最后一次少量水洗液于试管中,滴入1~2滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净;
(4)根据关系式ZnCO3•xZn(OH)2 ~(x+1)ZnO
125+99x 81(x+1)
10.55g 8.1g
解得:x=3,
故答案为:3.
点评 本题考查混合物的分离和提纯,侧重考查学生分析问题、解答问题能力,明确流程图中各个步骤发生的反应及溶液中存在的微粒,知道常见离子的检验方法及实验现象,题目难度中等.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:解答题
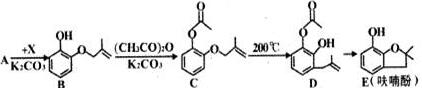
 .
.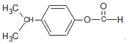 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
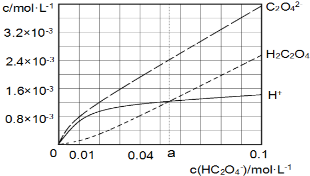 25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )
25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随c(HC2O4)的变化趋势如下图所示.下列说法正确的是( )| A. | 当c(HC2O4ˉ)=0.1mol•Lˉ1时,c(H+)>c(C2O42-)-c(H2C2O4) | |
| B. | 当c(HC2O4ˉ)>amol•Lˉ1时,c(H+)<c(H2C2O4),HC2O4ˉ的水解程度大于电离程度 | |
| C. | HC2O4ˉ?C2O42-+H+,Ka(HC2O4ˉ)=a | |
| D. | 将0.08mol•Lˉ1H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4ˉ)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OHˉ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
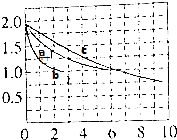
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ① | 160 | $\frac{2}{3}$ | 1 |
| ② | x | $\frac{2}{3}$ | 5 |
| ③ | 260 | y | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有如下化学反应:2A(g)+B(g)?2C(g),△H<0.
有如下化学反应:2A(g)+B(g)?2C(g),△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解氯化钠溶液:2Cl-+2H+═H2↑+Cl2↑ | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Fe(NO3)2 溶液中滴加少量稀盐酸:Fe2++NO3-+4H+═Fe3++NO↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com