
| A. | CH3COOH溶液的导电能力比相同浓度的HCl溶液小 | |
| B. | 在25℃时,0.1mol/L的CH3COOH溶液pH约为3 | |
| C. | 在25℃时,1mol/L的CH3COONa溶液的pH约为9 | |
| D. | 0.1molCH3COOH和0.1 mol NaOH恰好中和生成CH3COONa |
分析 证明CH3COOH为弱酸,可从以下角度判断:①等浓度的HCl、CH3COOH导电能力;②比较二者的电离程度,判断是否完全电离;③判断是否存在电离平衡;④比较二者对应的盐溶液的酸碱性等.
解答 解:A.等浓度的HCl、CH3COOH导电能力HCl强于CH3COOH,说明HCl电离程度大于CH3COOH,而HCl为强酸,则CH3COOH为弱酸,故A不选;
B.在25℃时,0.1mol/L的CH3COOH溶液pH约为3,说明CH3COOH没有完全电离,溶液中存在电离平衡,即CH3COOH是弱电解质,故B不选;
C.CH3COONa溶液显碱性,说明醋酸根离子水解,即CH3COOH是弱电解质,故C不选;
D.0.1molCH3COOH和0.1 mol NaOH恰好中和生成CH3COONa,与CH3COOH的酸性强弱无关,故D选.
故选:D.
点评 本题考查弱电解质的实验方法设计,题目难度中等,注意判断弱电解质的角度,把握正确的判断方法,侧重于考查学生的分析能力和应用能力.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:填空题
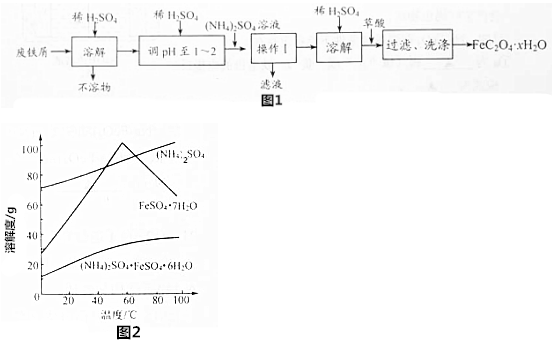
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是制造光导纤维的材料 | B. | Fe3O4常用于红色油漆和涂料 | ||
| C. | Na2SiO3常用作制木材防火剂 | D. | NaHCO3常用作面粉发泡剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠水解:S2-+2H2O?H2S↑+2OH- | |
| B. | 硫氢化钠水解:HS-+H2O??H3O++S2- | |
| C. | 硫化钾水解:S2-+H2O═HS-+OH- | |
| D. | 硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO2-+6H2O═4Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
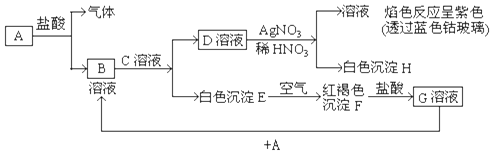
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与镁 | B. | 铁与锌 | C. | 铝与铁 | D. | 镁与铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2+3H2(g)$?_{500℃,30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 稀盐酸和 稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH-(aq)=H2O(1)△H=-57.3 kJ•mol-1 | |
| D. | 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1)△H=+285.8 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com