
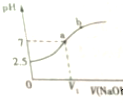
| A. | NaHSO3溶液呈酸性 | B. | V1<10mL | ||
| C. | 在a点,c(Na+)=c(SO32- )+c(HSO3-) | D. | 在b点,c(Na+)>c(SO3 2- ) |
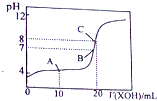
分析 A、图象分析可知,在未加入氢氧化钠溶液时亚硫酸氢钠溶液PH=2.5,常温下显酸性;
B、在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液10ml,恰好反应生成亚硫酸钠,溶液中亚硫酸根离子水解显碱性,若溶液呈中性,则加入氢氧化钠溶液体积小于10ml;
C、a点时溶液呈中性,结合溶液中电荷守恒分析判断离子浓度大小;
D、b点时混合溶液呈碱性,溶液中为亚硫酸钠或亚硫酸钠与氢氧化钠的混合溶液.
解答 解:A、在未加入氢氧化钠溶液时,亚硫酸氢钠溶液PH=2.5,常温下NaHSO3溶液呈酸性,故A正确;
B、在10mL 0.1mol•L-1 NaHSO3溶液中逐滴滴加0.1mol•L-1 NaOH溶液10ml,恰好反应生成亚硫酸钠,反应的化学方程式为:NaHSO3+NaOH=Na2SO3+H2O,溶液中亚硫酸根离子水解显碱性,若溶液呈中性,则加入氢氧化钠溶液体积小于10ml,即V1<10mL,故B正确;
C、a点时溶液呈中性,c(H+)=c(OH-),溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-),得到c(Na+)=2c(SO32-)+c(HSO3-),故C错误;
D、b点时混合溶液呈碱性,溶液中为亚硫酸钠或亚硫酸钠与氢氧化钠的混合溶液,钠离子浓度一定等于亚硫酸根离子,所以在b点,c(Na+)>c(SO3 2- ),故D正确;
故选C.
点评 本题考查了物质反应后的溶液酸碱信息分析,图象的特征分析判断,盐类水解和电解质溶液中电荷守恒的理解应用是解题关键,题目难度中等.


 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向烧碱溶液中加入铝:Al+2OH-=AlO2-+H2↑ | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O | |
| C. | 将饱和FeCl3溶液滴入废水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 用Fe2+将饮用水中少量ClO2-还原成为Cl-:4Fe2++ClO2-+4H+=4Fe3++Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
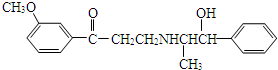
| A. | 该分子中含有酚羟基 | |
| B. | 该物质可以和浓氢溴酸发生取代反应 | |
| C. | 该物质可以和银氨溶液发生银镜反应 | |
| D. | 该分子苯环上的一氯取代物有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 检验Fe2(SO4)3溶液中是否含有FeSO4 | 取少量溶液于试管,加入几滴0.1mol/L KMnO4溶液 |
| B | 证明Al(OH)3是两性氢氧化物 | 取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
| C | 使蛋白质能变性 | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,产生沉淀 |
| D | 除去Na2CO3中的NaCl | 溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32- | |
| B. | 向硫酸氢钠溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 硫氢根离子的电离方程式:HS-+H2O?H3O++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在苯和液溴的混合物中,添加少量铁屑后马上剧烈反应 | |
| B. | 伸出烧瓶的导管要有足够长度,其作用是导出气体和充分冷凝回流逸出的苯和溴蒸气 | |
| C. | 导管末端应插入锥形瓶内水面以下,有利于HBr气体被吸收 | |
| D. | 反应后烧瓶中是褐色的油状液体,倒入盛有足量浓烧碱溶液的分液漏斗中,充分振荡后静置,上层液体是无色的溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2与62gNa2O中所含阴离子数目都是NA | |
| B. | 常温常压下,NA个Cl2通入水中,转移电子数为NA | |
| C. | 电解精炼铜时,若阴极得到2NA个电子,则阳极质量减少64g | |
| D. | 5.6g铁粉与足量硫粉充分反应,转移电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:简答题
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第IIIA族),他们的化合物或单质都有重要用途。回答下列问题:
(1)写出基态镓原子占据的最高能层符号为________,基态铝原子有____个不同能级;基态镓原子的核外电子排布式为 。
(2)已知:无水氯化铝在178℃升华,它的蒸气是缔合的双分于(Al2Cl6),更高温度下Al2Cl6则离解生成A1Cl3单分子。
①固体氯化铝的晶体类型是 ;
②写出Al2Cl6分子的结构式 ;
③单分子A1Cl3的立体构型是 ,缔合双分子Al2Cl6中Al原子的轨道杂化类型是 。
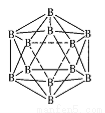
(3)晶体硼的结构单元是正二十面体的原子晶体,其中含有20个等边三角形和一定数目的顶角,每个顶角各有一个原子,则这个基本结构单元由____个1硼原子组成,共含有____B-B键。
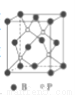
(4)磷化硼(BP)是一种有价值的耐磨硬涂层材料,它是通过高温氢气氛围下(750℃)三溴化硼和三溴化磷反映值得的。BP晶胞如图所示。
①在BP晶胞中B的堆积方式为____。
②当晶胞晶格参数为acm(即途中立方体的每条边长为acm)时,磷化硼晶胞的密度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y是元素周期表前20号元素,且X的原子序数比Y大4,请填空(X、Y要用具体的元素符号表示):
X、Y是元素周期表前20号元素,且X的原子序数比Y大4,请填空(X、Y要用具体的元素符号表示):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com