
| A、100mL蒸馏水 |
| B、100mL 0.2mol?L-1 AgNO3 |
| C、100 mL 0.1mol?L-1 AlCl3 |
| D、100mL 0.1 mol?L-1盐酸 |


科目:高中化学 来源: 题型:
| A、78g苯含有碳碳双键的数目为3NA |
| B、常温常压下,22.4L二氧化碳含有的原子总数为3NA |
| C、1mol Fe与足量稀HNO3反应,转移3NA个电子 |
| D、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
| 催化剂 |
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
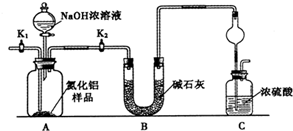
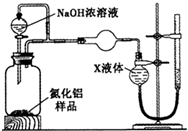
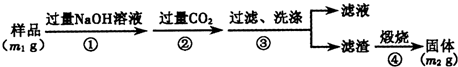
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素A在周期表中的位置为第2周期ⅥA族 |
| B、元素A、B、C的原子半径由大到小的顺序为r(C)>r(B)>r(A) |
| C、A、B两种元素的氢化物的稳定性A>B |
| D、1mol C2B2与足量的AB2完全反应转移约6.02×1023个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) |
| B、c(H2C2O4)>c(C2O42-) |
| C、c(H+)+c(Na+)=c(OH-)+c(C2O42-)+c(HC2O4-) |
| D、c(Na+)>c(HC2O4-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)>c(OH-) |
| B、c(Na+)=c(CH3COO-) |
| C、c(CH3COO-)>c(OH-) |
| D、c(Na+)<0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com