

| A、1:8 | B、1:4 |
| C、1:2 | D、1:1 |
科目:高中化学 来源: 题型:
 参考下列图表和有关要求回答问题:
参考下列图表和有关要求回答问题:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去Fe2(SO4)3溶液中混有的Fe SO4:加入足量新制氯水 |
| B、除去FeCl2溶液中混有的FeCl3:加入足量铁粉,过滤 |
| C、铝粉中的镁粉,加入足量氢氧化钠溶液,过滤 |
| D、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
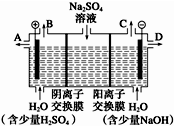 芒硝化学式为Na2SO4?10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4?10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验溶液中是否有SO42-可依次加入的试剂是BaCl2溶液和稀盐酸 |
| B、在pH=2的溶液中可能大量含有:Na+、AlO2-、CO32-、SO32- |
| C、在常温下加入铝粉有氢气放出,则溶液中可能大量含有:K+、Na+、OH-、NO3- |
| D、使紫色石蕊试液变蓝色的溶液中可能大量含有:K+、Na+、Ca2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
| C、5×10-10 | ||
| D、5×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com