
在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%,在用CH3C≡CH合成CH2=C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有( )
A.CO2和H2O B.CO和CH3OH C.CH3OH和H2 D.H2和CO2
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:阅读理解
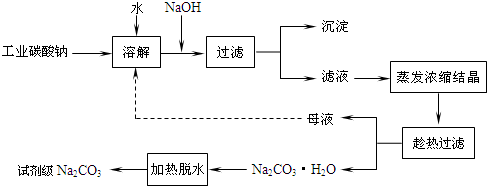
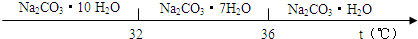
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(新课标Ⅱ卷解析版) 题型:填空题
[化学—选修2:化学与技术](15分)
锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造图如图(a)所示。

回答下列问题:
(1)①普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH。该电池中,负极材料主要是____________________,电解质的主要成分是__________,正极发生的主要反应是________________________________________________________。
②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是_______。
(2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。

①图(b)中产物的化学式分别为A_______,B________。
②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为_______。
③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是____。(填化学式)
查看答案和解析>>
科目:高中化学 来源:北京期末题 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组用含铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体(FeSO4?7H2O)和胆矾晶体(CuSO4?5H2O),以探索工业废料的再利用。其实验方案如下图:
![]()

试回答下列问题:
![]() (1)写出滤液A转化为沉淀D的离子方程式_________________________________。
(1)写出滤液A转化为沉淀D的离子方程式_________________________________。
![]() (2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径_________(填“I”或“II”),理由是
(2)由滤液A制AlCl3溶液的途径有I和II两条,你认为合理的是途径_________(填“I”或“II”),理由是
(3)从滤液E中得到绿矾晶体的实验操作是(不考虑E中的溶质被氧化这一因素):
_____________________________________________________________________。
(4)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣F中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总的化学方程式为_________________________________。
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否合理?___________ 。理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com