
| A. | 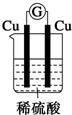 | B. | 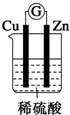 | C. | 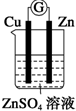 | D. | 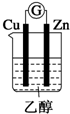 |
科目:高中化学 来源: 题型:选择题
| A. | C2H6和C3H8 | B. | C4H10和C6H6 | C. | CH2O和 C2H4O2 | D. | C3H6和C3H8O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
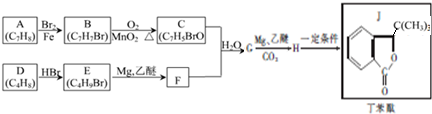
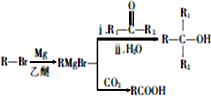
 .
.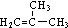 +HBr→(CH3)3CBr.
+HBr→(CH3)3CBr.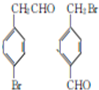 .
.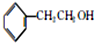 )
) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O.1mol/LKHC03溶液与O.1mol/L KOH溶液等体积混合,所得溶液中:c(K+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 20ml O.lmol/L CH3COONa溶液与lOmLO.lmol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(Cl-)>(CH3COO-)>c(H+)>c(CH3COOH) | |
| D. | pH=2的H2C2O4溶液与pH=l2的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 晶体名称 | 碘化钾 | 干冰 | 石墨 | 碘 |
| 晶体中 的粒子 | 阴、阳离子 | 分子 | 原子 | 分子 |
| 粒子间 的作用 | 离子键 | 分子间 作用力 | 共价键 | 分子间 作用力 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
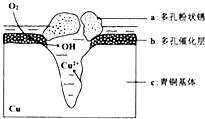 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①和③ | C. | ①③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com