
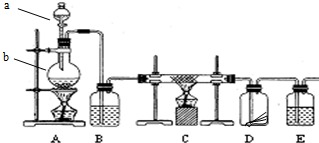
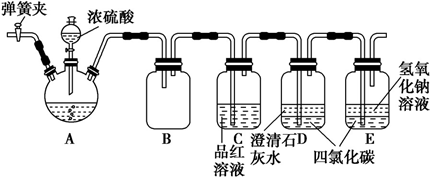
分析 (1)仪器a为分液操作使用的分液漏斗;A装置中铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(2)根据题干信息:需要除去制得的SO2中存在的少量水蒸气和O2,则首先除少量水蒸气,所以B装置用于除去水蒸气;
(3)根据题干信息:需要除去制得的SO2中存在的少量水蒸气和O2,B装置用于除去水蒸气,则C装置需要除去氧气;
(4)装置D中装的是小麦秸秆,探究的是SO2的漂白性;装置E目的是吸收多余的二氧化硫,避免二氧化硫污染大气,据此进行解答.
解答 解:(1)仪器a为分液操作使用的分液漏斗;A装置中铜与浓硫酸反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:分液漏斗;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)根据实验目的,需要除去制得的SO2中存在的少量水蒸气和O2,则首先除少量水蒸气,所以B装置用于除去水蒸气,装有浓硫酸,
故答案为:浓硫酸;除去混合气体中的水蒸气;
(3)装置C需要除去氧气,燃烧管中放的是铜丝网,在加热条件下铜与氧气反应生成氧化铜,从而将氧气除去,反应的化学方程式是2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;故答案为:铜丝网;除去氧气;2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(4)装置D中装的是小麦秸秆,二氧化硫具有漂白性,能够使小麦秸秆褪色;由于二氧化硫有毒,直接排放会污染大气,所以装置E装有装有NaOH溶液,吸收多余的二氧化硫,避免二氧化硫污染大气,
故答案为:褪色;NaOH溶液.
点评 本题考查了浓硫酸的化学性质,题目难度中等,注意掌握浓硫酸具有的化学性质,能够正确书写铜与浓硫酸反应的方程式,明确二氧化硫的漂白性及漂白原理.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平的两个托盘上各放一张大小一样的纸,然后将NaOH固体放在纸上进行称量 | |
| B. | 把称量的NaOH固体放入盛有适量蒸馏水的烧杯中,溶解后立即把溶液转移到容量瓶中 | |
| C. | 用蒸馏水洗涤烧杯、玻璃棒2~3次,每次洗涤后的溶液都注入容量瓶中 | |
| D. | 沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.
某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
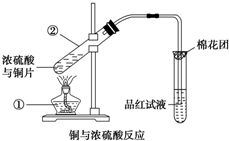 如图是铜与浓硫酸反应的实验装置图,请回答下列问题.
如图是铜与浓硫酸反应的实验装置图,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com