氢气是一种新型的绿色能源,又是一种重要的化工原料.
(1)氢气燃烧热值高.实验测得,在常温常压下,1g H
2完全燃烧生成液态水,放出142.9kJ热量.则H
2燃烧的热化学方程式为______.
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景.现氢氧燃料电池进行图1所示实验:

①氢氧燃料电池中,正极的电极反应式为______;
②右图装置中,某一铜电极的质量减轻3.2g,则a极上消耗的O
2在标准状况下的体积为______L.
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N
2(g)+3H
2(g)?2NH
3(g);△H=-92.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N
2、H
2和NH
3的量),反应速率与时间的关系如图2所示.图2中t
1时引起平衡移动的条件可能是______,其中表示平衡混合物中NH
3的含量最高的一段时间是______,若t
-t
1,t
1-t
3,t
3-t
5这三段平衡常数分别用K
1,K
2,K
3表示,那么K
1,K
2,K
3的大小关系是______.
②若在恒温、恒压条件下向平衡体系中通入氩气,平衡______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H______(填“增大”、“减小”或“不改变”).
温度为T℃时,将2a mol H
2和 a mol N
2放入0.5L密闭容器中,充分反应后测得N
2的转化率为50%.则反应的平衡常数为______.


 O2(g)=H2O(1)△H=-285.8kJ/mol,故答案为:H2(g)+
O2(g)=H2O(1)△H=-285.8kJ/mol,故答案为:H2(g)+ O2(g)=H2O(1)△H=-285.8kJ/mol;
O2(g)=H2O(1)△H=-285.8kJ/mol;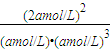 =
=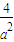 (mol/L)-2;
(mol/L)-2; (mol/L)-2.
(mol/L)-2.

 氢气是一种新型的绿色能源,又是一种重要的化工原料.
氢气是一种新型的绿色能源,又是一种重要的化工原料.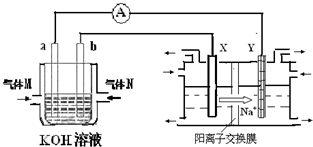 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.