
【题目】下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-===Fe(OH)3↓ |
B | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
C | H+、Fe2+、SO | Ba(NO3)2溶液 | SO |
D | Na+、Al3+、Cl- | 少量澄清石灰水 | Al3++3OH-===Al(OH)3↓ |
A. A B. B C. C D. D
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子:化合物B2E的晶体为离子晶体,E原子核外的M层中有两对成对电子:C元素是底壳中含量最高的金属元素:D单质的熔点在同周期元素形成的单质中是最高的:F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为______(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是______。
(3)E的最高价氧化物分子的空间构型是______。是______分子(填“极性”“非极性”)
(4)F原子的价层电子排布式是_____。
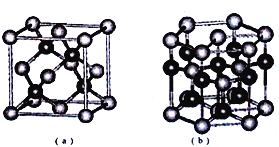
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子)。其化学式为_____。(a)中E原子的配位数为______,若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有_____个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)________(b)(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CeO2是一种重要的稀土氧化物,可利用氟碳铈矿(主要成分为CeFCO3)来制备。其工艺流程如下:

已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是_________________。
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的_______(填原子符号,下同)、__________、_____________促进了CeO2的溶解。
(3)“反萃取”时发生反应的离子方程式为____________________。
(4)若缺少“洗氟”这一环节,则所得产品的质量将___________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.萃取,分液前需对分液漏斗检漏
D.用酒精萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝与NO3-在酸性或碱性条件下均可反应,回答下列问题:
(1)为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,完善并配平该反应:__Al +___NO3- + ___OH- = ____________+ ____N2↑ + ____H2O。每消耗1mol NO3-,转移的电子数目为_____。
(2)某同学取一定质量的铁铝合金与100mLxmol/L稀硝酸充分反应,反应过程中没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。

①写出EF段发生反应的离子方程式_________________________________________。
② C点对应的溶液中含有的阳离子除Na+外,还含有___________________________。
③ x=_________。
④铁铝合金中铝的物质的量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中要配制2mol/L的NaCl溶液980 ml,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
A. 980 mL,114.7g B. 500mL, 58.5g
C. 1000 mL, 117 g D. 1000mL,117.0g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、Fe2O3、SiO2。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:

(1)试剂A的化学式为_____________;固体b的化学式为______________。
(2)生成气体X的化学方程式为_________________________________。
(3)已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH如表所示
Fe3+ | Cu2+ | Fe2+ | |
开始沉淀的pH | 2.7 | 5.1 | 8.1 |
沉淀完全的pH | 3.0 | 6.7 | 9.6 |
加入足量双氧水的目的是___________________________________(用离子方程式表示)。设计实验方案证明加入的双氧水已足量_____________________________________(实验方案包括试剂、现象和结论)。
(4)① 试剂B的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂B可选用__________________。
A.NaOH溶液 B. Cu C.CuO D.Cu2(OH)2CO3
② 为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为________________。
(5)操作Ⅱ包括__________________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
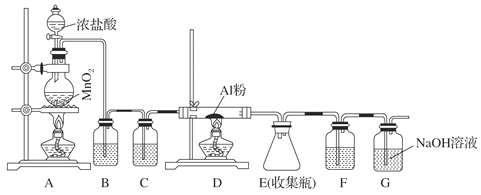
(1)其中装置A用来制备氯气,写出其离子反应方程式:_____________________________。
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________________。
(3)G为尾气处理装置,其中反应的化学方程式:___________________________________。
(4)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案__________(填“可行”,“不可行”)并说明理由__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(二)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com