
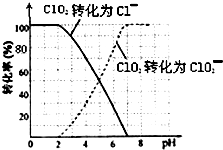
 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.比Cl2更好.| 1 |
| 2 |
| 0.0005cV1mol-0.002cV2mol |
| V×0.001L |
| c(V2-4V1) |
| 4V |
| c(V2-4V1) |
| 4V |


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
| A、高容量储氢材料的研制是推广应用氢氧燃料电池的关键问题之一 |
| B、发展低碳经济,推广可利用太阳能的城市照明系统有利于节能减排、改善环境质量 |
| C、仅需要托盘天平、砝码、药匙、一定规格的容量瓶、烧杯、玻璃棒这些仪器就可以准确配制出一定浓度的NaCL溶液 |
| D、节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.5mol?L-1稀硫酸与1L 1mol?L-1氢氧化钠溶液反应放出57.3kJ的热量:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l);△H=-57.3kJ?mol-1 | ||||
| B、某酸的酸式盐NaHY水溶液显碱性,则H2Y?2H++Y2- | ||||
| C、纯碱溶液显碱性的原因用离子方程式可表示为:CO32-+2H2O?H2CO3+2OH- | ||||
D、以惰性电极电解KCl溶液的离子方程式为:2Cl-+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.
铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为某市售盐酸试剂瓶标签上的部分数据.问:
如图为某市售盐酸试剂瓶标签上的部分数据.问:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com