
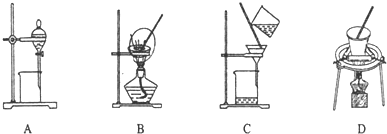
| A. | 过滤时,液面超过滤纸的边缘 | |
| B. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| C. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| D. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化合物 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| 完全沉淀的Ph | 10.5 | 4.3 | 5.3 |
| 开始溶解的pH | -- | 7.8 | 9.2 |
| Ksp近似值 | 10-12 | 10-14 | 10-31 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色 | NaClO水解显碱性 |
| B | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
| C | 向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色 | 原溶液中一定含有Fe2+ |
| D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
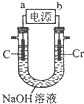
 如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜.
如图所示,甲、乙两池的电极材料都是铁棒与碳棒,丙池是电解精炼铜.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com