
【题目】已知: 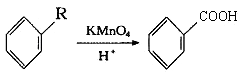 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.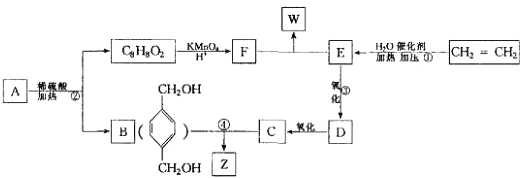
回答下列问题:
(1)写出反应类型:① , ② .
(2)写出化学反应方程式: ③
④
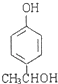
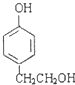
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为 ![]() , ,
, ,
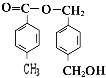
(4)A的结构简式可能为(只写一种即可) .
【答案】
(1)加成反应;水解反应
(2)2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;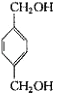 +2CH3COOH
+2CH3COOH ![]()
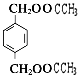 +2H2O
+2H2O
(3) 、
、  、
、 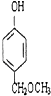
(4)
【解析】解:乙烯与水发生加成反应生成E为CH3CH2OH,E发生氧化反应生成D为CH3CHO,D进一步氧化生成C为CH3COOH.B和C按1:2发生酯化反应生成Z为 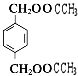 ,A水解得到C8H8O2与B,可推知A含有酯基,C8H8O2中含﹣COOH,且能被酸性高锰酸钾溶液溶液氧化得到F,F和E按1:2反应生成W,则F为二元羧酸,故C8H8O2为
,A水解得到C8H8O2与B,可推知A含有酯基,C8H8O2中含﹣COOH,且能被酸性高锰酸钾溶液溶液氧化得到F,F和E按1:2反应生成W,则F为二元羧酸,故C8H8O2为 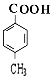 ,F为
,F为 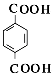 ,W为
,W为 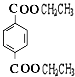 ,A为
,A为 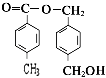 .(1)反应①是乙烯与是发生加成反应生成乙醇,反应②A在酸性条件下的水解反应,所以答案是:加成反应;水解反应;(2)反应③的化学反应方程式为:2CH3CH2OH+O2
.(1)反应①是乙烯与是发生加成反应生成乙醇,反应②A在酸性条件下的水解反应,所以答案是:加成反应;水解反应;(2)反应③的化学反应方程式为:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,反应④的化学反应方程式为:
2CH3CHO+2H2O,反应④的化学反应方程式为: 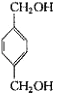 +2CH3COOH
+2CH3COOH ![]()
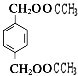 +2H2O;所以答案是:2CH3CH2OH+O2
+2H2O;所以答案是:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O; 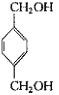 +2CH3COOH
+2CH3COOH ![]()
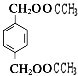 +2H2O;(3)B为
+2H2O;(3)B为  ,与B互为同分异构体,属于酚类则含有酚羟基,且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为:
,与B互为同分异构体,属于酚类则含有酚羟基,且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为: ![]() 、
、 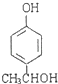 、
、 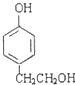 、
、 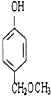 ,所以答案是:
,所以答案是:  、
、  、
、 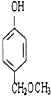 ;(4)根据以上分析,A为
;(4)根据以上分析,A为 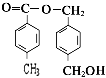 ,所以答案是:
,所以答案是:  .
.


科目:高中化学 来源: 题型:
【题目】在微生物作用下,电解有机废水(含CH3COOH),实现废水处理的同时,可获得清洁能源H2 . 其原理如图所示.下列有关说法正确的是( ) 
A.电极A为负极
B.电解中生成的CO2与H2物质的量之比为1:1
C.阳极反应为:CH3COOH一8e﹣+8OH﹣═2CO2↑+6H2O
D.电解前后,阴极室的pH几乎保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能说明醋酸是弱电解质的是
A. 醋酸钠溶液呈碱性 B. 醋酸溶液中存在醋酸分子
C. 醋酸溶液导电性差 D. 0.1mol/L醋酸溶液的pH=2.9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丙苯( ![]() ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空:
(1)异丙苯的1H﹣NMR谱图中吸收峰的数目是组.
(2)工业上主要通过苯与丙烯通过分子筛固体酸催化剂工艺获得异丙苯,写出其方程式为 , 反应类型为反应.
(3)α﹣甲基苯乙烯( ![]() )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示).
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国发行的第五套人民币中,1元、5角、1角硬币的材料分别为钢芯镀镍合金(1元)、钢芯镀铜合金(5角)和铝合金(1角)。下列说法正确的是( )
A.铸造硬币的合金实际价值低于面值
B.铸造硬币的合金在海水中也不会被腐蚀
C.三种面值不同的硬币材质不同是因为它们的实际价值不同
D.应鼓励人们尽量多地收集硬币
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000molL﹣1NaOH溶液滴定20.00mL0.1000molL﹣1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( ) 
A.①处水的电离程度大于②处水的电离程度
B.②处加入的NaOH溶液恰好将CH3COOH中和
C.③处所示溶液:c(Na+)<c(CH3COO﹣)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO﹣)>c(H+)>c(Na+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl36H2O)的工艺流程如图: 
回答下列问题:
(1)煅烧时粉碎硫铁矿的目的是 . 该反应的化学方程式 , 该反应中被氧化的元素是 .
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、;
(3)操作a为蒸发浓缩、冷却结晶、、、干燥,获得FeCl36H2O;
(4)焙烧产生的二氧化硫可以用来生产硫酸,其中利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:
0.1 | 0.5 | 1 | 10 | |
400 | 99.2% | 99.6% | 99.7% | 99.9% |
500 | 93.5% | 96.9% | 97.8% | 99.3% |
600 | 73.7% | 85.8% | 89.5% | 96.4% |
根据表中的数据判断该反应的正向属于(填“放热“或”吸热“)反应,理由是 .
(5)计算每生产1万吨98%硫酸所需要含80%FeS2的硫铁矿为吨(假设反应过程中硫的损失率为5%,结果保留一位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.
I.结晶水的测定:称取7.84g浅蓝绿晶体,加热至100℃失去结晶水,冷却至室温
后,称重,质量为5.68g.
Ⅱ.NH4+的测定:将上述5.68g固体置于如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入氮气,用40.00mL l molL﹣1的硫酸溶液吸收产生氨气.蒸氨结束后取下接收瓶,用2molL﹣1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00mLNaOH溶液.
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的溶液全部倒入锥形瓶中,向其中加入适量3%H2O2的溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后;测得其质量为1.6g. 回答下列问题:
(1)在实验I中,不可能用到的实验仪器是(填正确答案标号).
A.烧杯
B.铁架台(带铁圈)
C.坩埚
D.蒸发皿
E.酒精灯
F.干燥器
G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是 . 蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用式滴定管;可使用的指示剂为 .
(4)在实验中,检验沉淀是否洗净的方法是 .
(5)根据上述实验数据计算,该浅蓝绿晶体的化学式为 . 三颈瓶中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Na2CO3比NaHCO3溶解度大
B.Na2CO3比NaHCO3稳定
C.Na2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应得CO2物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com