
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )

A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
【答案】C
【解析】
试题A.根据图像可知:在压强不变时,升高温度,达到平衡时Y的体积分数增大,说明升高温度化学平衡向正反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,该反应的正反应是吸热反应,所以△H >0,正确;B.根据图像可知,在温度不变时,增大压强,Y的体积分数减小,说明增大压强,化学平衡向逆反应方向移动。根据平衡移动原理,增大压强,化学平衡向气体体积减小的方向移动,逆反应方向是气体体积减小的反应方向,所以m<n+p,正确;C.B的反应温度是300℃,C点的温度是500℃,由于该反应的正反应是吸热反应,升高温度,平衡正向移动,所以B、C两点化学平衡常数:KB<KC,错误;D.A、C两点温度相同,而压强:C<A,增大压强,化学反应速率加快,所以A、C两点的反应速率v(A)<v(C),正确。


科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
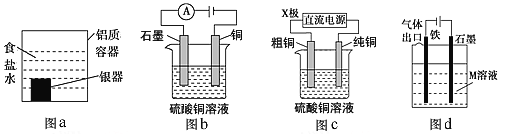
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:2Sb2S3+3O2+6Fe=Sb4O6+6FeS①;Sb4O6+6C=4Sb+6CO②。下列说法正确的是( )
A. 反应②说明高温下Sb还原性比C强
B. 反应①中每生成1 mol FeS时,共转移2mol电子
C. 每生成1 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
D. 反应①②中氧化剂分别是Sb2S3、Sb4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的电离方程式:
①H2SO4: ________
②NaOH: ________
③Fe2(SO4)3: ________
(2)写出下列化学反应的离子方程式:
①氢氧化钠与盐酸反应:________
②铁片与硫酸的反应:________
③硫酸铜与氢氧化钡的反应:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)![]() pC(g)。达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍。则下列说法正确的是( )
pC(g)。达到平衡时,维持温度不变,将气体体积缩小到原来的1/2,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍。则下列说法正确的是( )
A. m+n>pB. m+n<p
C. 平衡向正反应方向移动D. C的质量分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2 (g)+O2 (g)![]() 2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
2SO3 (g) ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是( )
A. 容器内压强p:p甲=p丙>2p乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比为k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+![]() O2(g)===CO(g) ΔH=-111 kJ·mol1
O2(g)===CO(g) ΔH=-111 kJ·mol1
①该催化重整反应的ΔH=____ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为______mol2·L2。下列可判断该反应达到平衡的是_________(填标号)。
A.单位时间内生成n mol的CH4,同时生成n mol的H2 B.v(CH4):v(CO)=1:2
C.容器中混合气体的密度不再发生变化 D.容器中的压强保持不变
(2)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1,则ΔH______(填“>”、“=”或“<”)0。
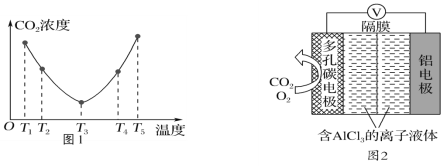
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________。
电池的正极反应式:6O2+6e-=6O;6CO2+6O=3C2O42-+6O2
反应过程中O2的作用是_________________。
(4)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-) = 2∶1,溶液pH=________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室制氢气的反应:Zn+2HCl= ZnCl2+H2↑。现用13.0gZn粉与一定量2mol/L稀盐酸充分反应,一段时间后Zn粉无剩余.
(1)用双线桥或单线桥标出电子转移的方向和数目
(2)比较H+和Zn2+氧化性强弱
(3)消耗盐酸的体积至少为多少升?
(4)生成ZnCl2的物质的量为多少?
(5)标准状况下,最多能收集到多少升气体?
(6)反应中转移的电子的个数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:现有下列7种物质:①NaHCO3②CH3COOH③BaSO4;④HF;⑤C2H5OH;⑥Al;⑦食盐水.其中属于强电解质的是 (填序号,下同),既能跟盐酸反应又能跟NaOH溶液反应的是 .
II:现有一瓶浓度为0.2mol/L的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取20.00mL该酸溶液,逐滴加入0.2mol/L的氢氧化钠溶液,恰好反应完全时所需碱液体积为20.00mL,请用化学用语回答:
(1)该酸不可能是 ;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为 ,用离子方程式说明溶液呈碱性的原因 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com