
如图所示装置Ⅰ是一种可充电池,装置Ⅱ为电解池,离子交换膜只允许Na+通过,充放电的化学方程式为Na2S4+3NaBr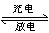 2Na2S2+NaBr3.闭合开关K时,b极附近先变红色.下列说法正确的是( )
2Na2S2+NaBr3.闭合开关K时,b极附近先变红色.下列说法正确的是( )
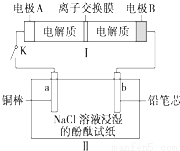
A.负极反应为4Na-4e-═4Na+
B.闭合K后,b电极附近的pH变小
C.当有0.01mol Na+通过离子交换膜时,b电极上析出标准状况下的气体112mL
D.闭合K后,a电极上产生的气体具有漂白性
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:选择题
下列对晶体类型判断正确的是( )
选项 | Na2B2O7 | CaF2 | H3BO3 | NH3 |
A | 原子晶体 | 金属晶体 | 原子晶体 | 分子晶体 |
B | 离子晶体 | 分子晶体 | 离子晶体 | 分子晶体 |
C | 离子晶体 | 离子晶体 | 分子晶体 | 分子晶体 |
D | 分子晶体 | 离子晶体 | 分子晶体 | 离子晶体 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式不正确的是
A.硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+=S↓+SO2↑+H2O
B.向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓↑
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl-
D.重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O 2H++2CrO42-(黄色)
2H++2CrO42-(黄色)
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上12月月考化学试卷(解析版) 题型:填空题
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),△H<0;
Ni(CO)4(g),△H<0;
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是_______(填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,△H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成含镍催化剂的中毒.为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫.
已知:CO(g)+ 1/2O2(g)=CO2(g) △H=-Q1 kJ•mol-1
S(s) +O2(g) =SO2(g) △H=-Q2 kJ•mol-1
则SO2(g) +2CO(g) =S(s) +2CO2(g) △H=________________;
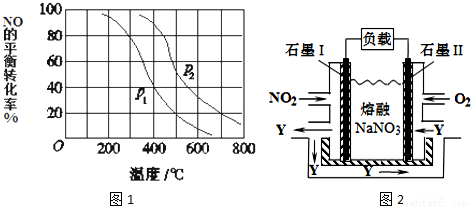
(3)对于反应:2NO(g)+O2═2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图1).
①比较P1、P2的大小关系_______________;
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为_______(最简分数形式);
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为_______________;若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为________L。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上一轮收官考试理综化学试卷(解析版) 题型:推断题
【化学—选修5:有机化学基础】
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
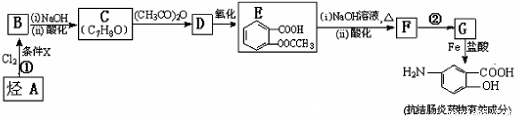
已知:(a)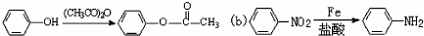
(1)烃A的结构简式是___________;
(2)①的反应条件是___________;②的反应类型是___________;
(3)下列对抗结肠炎药物有效成分可能具有的物质推测正确的是_________;
A.水溶性比苯酚好,密度比苯酚的大
B.能发生消去反应
C.能发生聚合反应
D.既有酸性又有碱性
(4)E与足量NaOH溶液反应的化学方程式是_________;
(5)写出所有符合下列条件的E的同分异构体的结构简式_________;
a.与E具有相同的官能团
b.苯环上的一硝基取代产物有两种
(6)已知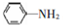 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物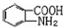 的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第五次月考化学试卷(解析版) 题型:填空题
已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:
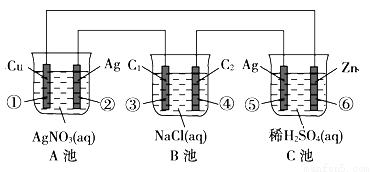
(1)各装置名称是:A池____________;C池____________;
(2)写出电极上发生的反应:②____________;⑥____________;
(3)当电路上有1mol电子流过时,①极上质量变化___________;⑥极上质量变化___________;
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省分校高三上期中测试理综化学试卷(解析版) 题型:填空题
将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
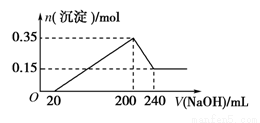
(1)加入NaOH 0~ 20mL 时发生反应离子方程式___________________,
加入NaOH 20~ 200mL 时发生反应离子方程式___________________,
加入NaOH 200~ 240mL 时发生反应离子方程式___________________,
(2)镁和铝的总质量为________g
(3)硫酸的物质的量浓度为___________ mol/L
(4)生成的氢气在标准状况下的体积为__________L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上期中测试化学试卷(解析版) 题型:选择题
对可逆反应4NH3(g)+5O2(g)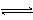 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
A.化学反应速率关系是:2v正(NH3)=3v正(H2O)
B.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.达到化学平衡时,4v正(O2)=5v逆(NO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com