
| A. | 0.05 mol•L-1的H2SO4溶液pH=1 | |
| B. | 0.001 mol•L-1的NaOH溶液pH=11 | |
| C. | 0.005 mol•L-1的H2SO4溶液与0.01 mol•L-1的NaOH溶液等体积混合,混合溶液pH为6,溶液显酸性 | |
| D. | 完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL |
分析 100℃的温度下,水的离子积KW=1×10-12,所以该温度下的中性溶液中pH=6,pH小于6的为酸性溶液,大于6的为碱性溶液,pH=-lgc(H+),强酸和强碱反应的混合溶液呈中性时,氢离子和氢氧根离子的物质的量相等,注意碱性溶液中氢氧根离子浓度的计算方法.
解答 解:100℃的温度下,水的离子积KW=1×10-12,所以该温度下的中性溶液中pH=6,
A.0.05 mol•L-1的硫酸溶液中,C(H+)=0.05 mol•L-1×2=0.1mol/L,所以pH=1,故A正确;
B.0.001mol/L的氢氧化钠溶液,C(H+)=10-9 mol/L,pH=9,故B错误;
C.0.005 mol•L-1的硫酸与0.01 mol•L-1的氢氧化钠溶液等体积时,n(H+)=n(OH-),所以硫酸和氢氧化钠恰好反应,溶液呈中性,pH为6,故C错误;
D.pH=3的硫酸中,C(H+)=10-3 mol/L,pH=11的NaOH溶液中C(OH-)=0.1mol/L,中和pH=3的硫酸溶液50 mL,需要pH=11的NaOH溶液0.5mL,故D错误;
故选A.
点评 本题考查pH的简单计算,注意碱性溶液中氢氧根离子浓度和pH的换算,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 10个中子的氧原子的核素符号:${\;}_{8}^{18}$O | |
| B. | H2O分子的结构式:H-O-H | |
| C. | Na的原子结构示意图: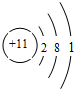 | |
| D. | 氮气的电子式::N:::N: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 和
和 (A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
(A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com