
(每空1分,共8分) 实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各小题
填写所示仪器名称A B
(2)实验步骤:
连接仪器、_____________、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是 ;装置E中足量酸性KMnO4溶液的作用是 ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是 ;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填“能”或“否”),试管D中发生反应的离子方程式是
(1)A:分液漏斗 ; B:圆底烧瓶; (2)检查装置的气密性
(3)①Cu+2H2SO4(浓)  CuSO4+ SO2↑+2H2O 除去SO2气体
CuSO4+ SO2↑+2H2O 除去SO2气体
②盛有Na2SiO3溶液的试管中出现白色沉淀 ③否 ; SO2+2HCO3-=SO32-+ H2O+2CO2↑
或SO2+HCO3-=HSO3-+CO2↑。
解析试题分析:(1)填写所示仪器名称A分液漏斗,B是圆底烧瓶 ;(2)实验步骤:连接仪器、检查装置的气密性、、加药品后,打开a、然后滴入浓硫酸,加热。(3)①铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓) CuSO4+ SO2↑+2H2O;装置E中足量酸性KMnO4溶液的作用是 除去CO2气体中SO2杂质气体。②元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以能说明碳元素的非金属性比硅元素非金属性强的实验现象是盛有Na2SiO3溶液的试管中出现白色沉淀。③由于亚硫酸不是S元素的最高价含氧酸,所以不能依据试管D中的实验现象,来证明硫元素的非金属性强于碳元素的非金属性。试管D中发生反应的离子方程式是SO2+2HCO3-=SO32-+ H2O+2CO2↑;或SO2+ HCO3-=HSO3-+CO2↑。
CuSO4+ SO2↑+2H2O;装置E中足量酸性KMnO4溶液的作用是 除去CO2气体中SO2杂质气体。②元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,所以能说明碳元素的非金属性比硅元素非金属性强的实验现象是盛有Na2SiO3溶液的试管中出现白色沉淀。③由于亚硫酸不是S元素的最高价含氧酸,所以不能依据试管D中的实验现象,来证明硫元素的非金属性强于碳元素的非金属性。试管D中发生反应的离子方程式是SO2+2HCO3-=SO32-+ H2O+2CO2↑;或SO2+ HCO3-=HSO3-+CO2↑。
考点:考查元素的推断、元素的化合物的性质、检验、化学方程式、离子方程式的书写的知识。


科目:高中化学 来源: 题型:问答题
【选修3-物质的结构与性质】(15分)
上表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______(写出元素符号),②号元素基态原子的电子排布图为___。
(2) ①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的空间构型为________。
②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是____________。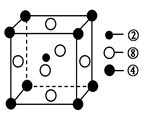
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_______。
(5) 若D元素与Fe元素形成某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C< B < E< D
Ⅱ.原子的最外层电子数:A=D C=E A + B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式 ;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式 。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。单质F发生 (填电化学腐蚀类型)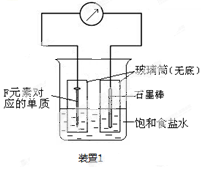
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为 ,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为 。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2,则该复盐的化学式为 。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某元素X的同位素构成的气态双原子分子有三种,相对分子质量分别为70、72、74。此三种分子的物质的量之比是9∶6∶l,请回答:
(1)X元素有几种同位素?质量数分别是多少?
(2)各同位素的原子数之比是多少?
(3)X元素的近似相对原子质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学设计实验以探究元素性质的递变规律,实验装置如图所示。
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为____________________,C中可观察到的现象是________。
(2)B装置的作用是__________________________________________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是________,由此得出碳、硅、氮三种元素非金属性的强弱顺序是________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:_______________________________________。
(5)C装置的作用是_________________________________________________________。
(6)实验结论:氧化性:____________________,非金属性:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关化学键和化合物的叙述不正确的是
| A.盐酸中含有H+和Cl-,所以HCl是离子化合物 |
| B.Na2O2中含有离子键和非极性共价键 |
| C.完全由非金属元素组成的化合物可能是离子化合物 |
| D.双原子或多原子的单质分子中均存在化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学变化的实质是旧的化学键断裂、新的化学键形成。据此判断下列变化是化学变化的是
| A.固体氯化钠溶于水 | B.冰经加热变成水蒸气 |
| C.氯化铵受热分解生成氯化氢和氨气 | D.氯化氢溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com