
分析 (1)AgCl的溶解度很小,但仍然能溶解;
(2)氯化银属于难溶物,在水溶液中存在溶解平衡;
(3)向该溶液中加NaCl固体,会产生同离子效应;
(4)向该溶液中加水,促进AgCl溶解,Ksp只与温度有关;
(5)难溶物的溶解是吸热的,加热促进溶解.
解答 解:(1)氯化银属于难溶物,其溶解度很小,但不是0,故错误;
(2)氯化银属于难溶物,在水溶液中存在溶解平衡AgCl(s)?Ag+(aq)+Cl-(aq),故正确;
(3)向该溶液中加NaCl固体,NaCl电离出的氯离子抑制AgCl溶解,则沉淀质量增大,故错误;
(4)向该溶液中加水,促进AgCl溶解,则氯化银溶解质量减小,温度不变,则Ksp不变,故错误;
(5)难溶物的溶解过程是吸热过程,升高温度促进溶解,所以加热该体系,可以推测沉淀量会减少,故正确;
故答案为:(2)(5).
点评 本题考查难溶物的溶解平衡,为高频考点,明确难溶物溶解特点、同离子效应、溶度积常数影响因素是解本题关键,注意:溶度积常数只与温度有关,与溶液浓度无关,题目难度不大.


科目:高中化学 来源: 题型:选择题
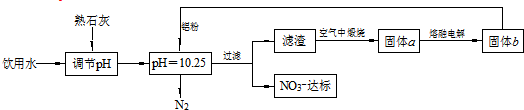
| A. | 该方案在调节pH时,若pH过大或过小都会造成Al的利用率降低 | |
| B. | 在加入铝粉的反应中,氧化产物和还原产物的物质的量之比为10:3 | |
| C. | 用熟石灰调节PH主要原因是价格便宜且引入的Ca2+对人体无毒 | |
| D. | 为了降低能耗,工业上往往用AlCl3代替固体a来制备固体b |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
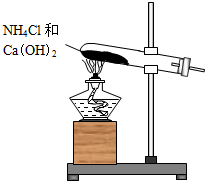 实验室通常用如图所示的装置来制取氨气.
实验室通常用如图所示的装置来制取氨气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8g NH4+含有的电子数为0.1NA | |
| B. | 2.3g金属钠反应生成Na2O2时失去的电子数为0.2NA | |
| C. | 标准状况下,11.2L的CCl4所含的分子数为0.5NA | |
| D. | 24.0g O2分子和24g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
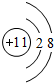 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 常温下,与水反应,A浮于水面而B却沉于水底 | |
| C. | 常温时,A能从酸中置换出氢,而B却不能 | |
| D. | 等物质的量的A、B分别从足量酸中置换生成H2:A比B的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ag+、NO3-、MnO4 - | B. | Fe3+、Fe2+、SO42-、Cl- | ||
| C. | K+、Na+、AlO2-、CO32- | D. | Al3+、Mg2+、SO42-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com