
【题目】甲、乙两烧杯中各盛放有100mL2mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,充分反应结束后测得生成的气体体积比为甲:乙=3:4,则加入铝粉的质量为( )
A.4.8gB.3.2gC.2.4gD.1.6g
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3。Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用该原理处理污水,设计装置如图所示。下列说法正确的是
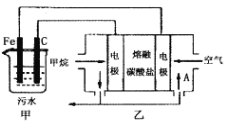
A.为了增加污水的导电能力,应向污水中加入适量的H2SO4溶液
B.甲装置中Fe电极的反应为Fe-3e-=Fe3+
C.当乙装置中有1.6gCH4参加反应,则C电极理论上生成气体体积为4.48L
D.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CxHy+H2O→CO+CO2+H2(未配平),工业上用甲烷、乙烷的混合气体利用上述反应生成氢气,反应后气体经干燥组成如下表所示,计算原混合气体中甲烷与乙烷的物质的量之比____________。
组分 | CO | CO2 | H2 |
体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.18g氨基(-ND2)中含有的电子数为10NA
B.56gFe与1molCl2充分反应后转移电子的数目为3NA
C.向密闭容器中加入2molNO和1molO2,充分反应后容器中产物分子的数目为2NA
D.向100mL0.1mol/LNH4Cl溶液中通入NH3至溶液为中性,其中NH4+的数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写下列空白
(1)写出Na2O2的电子式_____
(2)Al(OH)3在碱性溶液中的电离方程式为_____
(3)用离子方程式表示Na2S溶液呈碱性的原因_____
(4)在锌粒与稀硫酸的反应体系中,若滴加几滴CuSO4溶液,发现放出气体的速率明显加快,说明其原因:_____;若加入少量醋酸钠固体,发现放出气体的速率明显减慢,说明其原因_____。
(5)用惰性电极电解U形管中的饱和食盐水(已滴加酚酞),_____极附近溶液会变红。写出用惰性电极电解氯化铜溶液的化学反应方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,将前者加入后者时,无论前者是否过量,都能用同一个化学方程式表示的是( )
A. 盐酸 Na2CO3溶液 B. 氢氧化钠溶液 AlCl3溶液
C. Cl2 铁粉 D. CO2 澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究小组探究外界条件对化学反应mA(g)+n(B)(g) ![]() pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
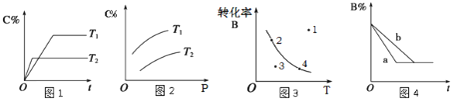
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v(正)>v(逆)的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用
用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用![]() 混合溶液与
混合溶液与![]() 溶液反应制取
溶液反应制取![]() ,相关装置如图。回答以下问题:
,相关装置如图。回答以下问题:
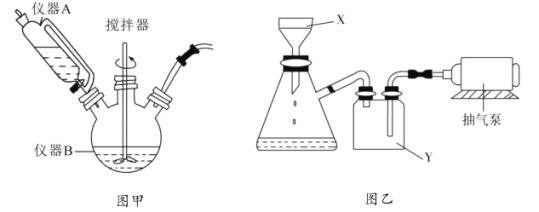
(1)图甲中仪器B的名称是__________,制备过程中![]() 过量会发生副反应生成
过量会发生副反应生成![]() ,为提高产率,仪器A中所加试剂应为__________________;
,为提高产率,仪器A中所加试剂应为__________________;
(2)丙图是体系pH随时间变化关系图,制取![]() 反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用
反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用![]() 混合溶液代替单一
混合溶液代替单一![]() 溶液,其中
溶液,其中![]() 的作用是____________;
的作用是____________;
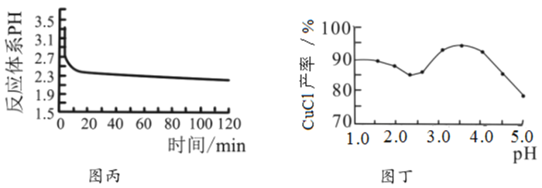
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤装置如图乙所示,抽滤所用的仪器包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。其中抽气泵的作用是使吸滤瓶与安全瓶中的____________________,跟常规过滤相比,采用抽滤的优点是____________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________。
(4)![]() 不稳定易分解为
不稳定易分解为![]() ,
,![]() 时
时![]() 的
的![]() ,
,![]() 的
的![]() ,把
,把![]() 固体和
固体和![]() 溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com