
����Ŀ����֪ X��Y��Z��Q��R��E����ǰ������Ԫ���У�ԭ������X��Y��Z��Q��R��E����ṹ��������Ϣ�����
Ԫ�� | �ṹ��������Ϣ |
X | ԭ�ӵ�L����s����������p������ |
Y | ԭ�Ӻ����L����3��δ�ɶԵ��� |
Z | �ؿ��к�������Ԫ�� |
Q | ���ʳ��³�ѹ�������壬ԭ�ӵ�M������1��δ�ɶԵ�p���� |
R | �˵������Y��Q�ĺ˵����֮�� |
E | N�ܲ���ֻ��һ�����ӣ�K��L��M����������� |
�������Ϣ�ش��й����⣺
(1)д��Ԫ��Y��ԭ�Ӻ���۵����Ų�ͼ��___________��X��һ���⻯����Է�������Ϊ26��������е������������ļ���֮��Ϊ______��
(2)X��Y��Z����Ԫ�صĵ�һ�������ɸߵ��͵�����Ϊ(дԪ�ط���)_____��
(3)X��ZԪ�طֱ�����Ԫ���γɵ���������У��е�ϸߵ�Ϊ(д��ѧʽ)______��ԭ����________��
(4)XZ��Y2���ڵȵ����壬д��������XZ�Ľṹʽ��_____��
(5)R��һ�������Ļ�ѧʽΪRCl36H2O����֪0.01mol RCl36H2O��ˮ��Һ���ù�����������Һ����������0.02mol AgCl��������������������____��
A��[R(H2O)6]Cl3 B��[R(H2O)5Cl]Cl2H2O
C��[R(H2O)4Cl2]Cl2H2O D��[R(H2O)3Cl3]3H2O
(6)������ESO4��ˮ��Һ����ε��백ˮ��������ɫ��������Ӧ�����ӷ���ʽΪ��__�������μӰ�ˮ�������������ܽ⣬�õ�����ɫ��Һ��д����Ӧ�����ӷ���ʽΪ��__��
���𰸡�![]() 3��2 N��O��C H2O ˮ���Ӽ�����γ������ʹ�е����� C��O B Cu2++2NH3H2O=Cu(OH)2��+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH��
3��2 N��O��C H2O ˮ���Ӽ�����γ������ʹ�е����� C��O B Cu2++2NH3H2O=Cu(OH)2��+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH��
��������
Xԭ�ӵ�L����s����������p������������Ϊ̼(C)��Yԭ�Ӻ����L����3��δ�ɶԵ��ӣ�����۵����Ų�ʽΪ2s22p3��YΪ��(N)��ZΪ�ؿ��к�������Ԫ�أ���ZΪ��(O)��Q�ĵ��ʳ��³�ѹ�������壬ԭ�ӵ�M������1��δ�ɶԵ�p���ӣ�����Ϊ��(Cl)��R�ĺ˵������Y��Q�ĺ˵����֮�ͣ�����Ϊ��(Cr)��Eԭ�ӵ�N�ܲ���ֻ��һ�����ӣ�K��L��M����������ӣ�����Ϊͭ(Cu)��
�����Ϸ�����֪��X��Y��Z��M��R��E�ֱ�ΪC��N��O��Cl��Cr��Cu��
(1)Y�ǵ�Ԫ�أ���ԭ�Ӻ���۵����Ų�ͼΪ![]() ��X��һ���⻯����Է�������Ϊ26������ΪC2H2���ṹʽΪH-C��C-H��������е������������ĸ����ֱ�Ϊ3��2�����ֵΪ3:2����Ϊ��
��X��һ���⻯����Է�������Ϊ26������ΪC2H2���ṹʽΪH-C��C-H��������е������������ĸ����ֱ�Ϊ3��2�����ֵΪ3:2����Ϊ��![]() ��3:2��
��3:2��
(2)X��Y��ZΪC��N��O������Ԫ����Nԭ�ӵ�2p������Ӱ��������һ�����ܳ��ַ��������Ե�һ�������ɸߵ��͵�����ΪN��O��C����Ϊ��N��O��C��
(3)X��ZԪ������Ԫ���γɵ��������ֱ�ΪCH4��H2O��H2O���Ӽ����γ������������е���ַ�������е�ϸߵ���H2O��ԭ����ˮ���Ӽ�����γ������ʹ�е����ߡ���Ϊ��H2O��ˮ���Ӽ�����γ������ʹ�е����ߣ�
(4)CO��N2���ڵȵ����壬������CO�ĽṹʽΪC��O����Ϊ��C��O��
(5)��֪0.01mol RCl36H2O��ˮ��Һ���ù�����������Һ����������0.02mol AgCl������������������2��Cl-���ɴ˿�ȷ��������������[R(H2O)5Cl]Cl2H2O����ѡB����Ϊ��B��
(6)������CuSO4��ˮ��Һ����ε��백ˮ��������ɫ����Cu(OH)2����Ӧ�����ӷ���ʽΪCu2++2NH3H2O=Cu(OH)2��+2NH4+�������μӰ�ˮ�������������ܽ⣬�õ�����ɫ��Һ[Cu(NH3)4](OH)2����Ӧ�����ӷ���ʽΪCu(OH)2+4NH3=[Cu(NH3)4]2++2OH������Ϊ��Cu2++2NH3H2O=Cu(OH)2��+2NH4+��Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�Ļ���ԭ�ϡ���0.5L����ܱ���ѹ�����У���Ԥ����95%�Ҵ�ˮ��Һ���Ƶ�0.2LNaOH��Һ�ӵ����������Ȳ����裬�ﵽ60�����ʱ��ͨ��CO��һ��ѹ������ʼ��Ӧ���¼����ѹ����ʱ��仯��ֱ��ѹ�����ٱ仯����ȴ��йѹ��ȡ����Ӧ����ˡ���ɲ��������䷴Ӧ���£�
��CO(g)��H2O(g)![]() HCOOH(aq) ��H1 K1
HCOOH(aq) ��H1 K1
��HCOOH(aq)��NaOH(aq)![]() HCOONa(s)��H2O(l) ��H2 K2
HCOONa(s)��H2O(l) ��H2 K2
��CO(g)��NaOH(aq)![]() HCOONa(s) ��H K
HCOONa(s) ��H K
��ش�
��1��K��___(��K1��K2��ʾ)����H��___(����H1����H2��ʾ)��
��2������ӿ췴Ӧ������ʣ����д�ʩ���е���___��
A������CO�ij�ʼѹ�� B���ʵ������¶�
C�������Ҵ�Ũ�� D�����ͽ���ת��
��3��CO��ѹ��ת���ʿ��Է�ӳ�ʻ������̡�CO��ѹ��ת���ʿ��Ա�ʾΪ��x(CO)��1��![]() ��100%��P0ΪCO��ʼѹ����P1ΪCOijʱ�̷�ѹ��HCOONa���ʿɱ�ʾΪ��Y(HCOONa)��
��100%��P0ΪCO��ʼѹ����P1ΪCOijʱ�̷�ѹ��HCOONa���ʿɱ�ʾΪ��Y(HCOONa)��![]() ��100%��n0(NaOH)��ʾͶ��NaOH�����ʵ�����n(HCOONa)��ʾ����HCOONa�����ʵ�����Ͷ�ϱ�r��
��100%��n0(NaOH)��ʾͶ��NaOH�����ʵ�����n(HCOONa)��ʾ����HCOONa�����ʵ�����Ͷ�ϱ�r��![]() ��
��
����60����£���Ͷ�ϱ�r��0.7ʱ��CO��ʼѹ���ֱ�Ϊ0.5Mpa��1.5Mpa��2.0Mpa�����x(CO)��t�Ĺ�ϵ��ͼ��ʾ��
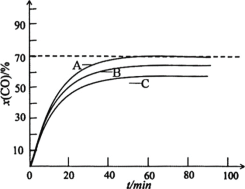
�ٱ�ʾ1.5Mpa������Ϊ___(��A��B��C��ʾ)��
����1.5Mpaʱ��Y(HCOONa)��87%����NaOH��ת����Ϊ___��
�۵�CO��ʼѹ��Ϊ1.5Mpa������60����£�����HCOONa���Ҵ����ܽ⡣����Y(HCOONa)��rʾ��ͼ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�����������ȷ����
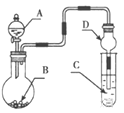
A.��AΪH2O2��BΪMnO2��C��ʢ��Na2S��Һ�� C����Һ�����
B.��AΪŨ���ᣬBΪMnO2��C��ʢ��KI������Һ��C����Һ����ɫ
C.��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢ��AlCl 3��Һ�� C���Ȳ�����ɫ������������ܽ�
D.��AΪŨH2SO4 ��BΪCaCO3��C��ʢ��Na2SiO3 ��Һ��C����Һ���ְ�ɫ������֤���ǽ�����S��C��Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ����ȼ�յ��ԭ��ʾ��ͼ�����մ�ͼ����ʾ������������ȷ������ ��
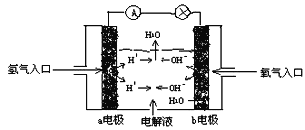
A. a�缫������
B. b�缫�ĵ缫��ӦΪ��4OH��- 4e����2H2O + O2��
C. ���Ӵ�a�缫���ɵ��Һ���ݵ�b�缫
D. ����ȼ�յ����һ�ֲ���Ҫ����ԭ����������ȫ�������ڵ���ڵ����ͷ���װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C����Ԫ�ص�ԭ���У���������A<B<C���Ҷ�С��18��AԪ��ԭ�ӵ������������Ǵ�����������2����BԪ��ԭ�ӵ�M���������L���������һ�룻CԪ��ԭ�ӵĴ�����������������������1���Իش��������⡣
(1)д������Ԫ�ص����ƺͷ��ţ�A______��B______��C______��
(2)��������Ԫ�ص�ԭ�ӽṹʾ��ͼ��A______��B______��C______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ�������ع�ҵ�У��������ʼ��ת����ϵ���£�
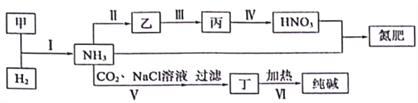
����˵������ȷ���ǣ�������
A. ��Ӧ��������������ԭ��Ӧ
B. ����ת���а����˰��������ᡢ��李�С�մ���Ĺ�ҵ��������
C. ��Ӧ���͢��еIJ��ֲ����������������ѭ������
D. ��ӦV�������Ȼ�����Һ��ͨCO2��������ͨNH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӷ�Ǧ����Ǧ�ࣨ��PbSO4��PbO2��Pb�ȣ��л���Ǧ��һ�ֹ����������£�

��֪��Ũ�����PbO2��Ӧ��Ksp��PbCl2����2.0��10��5��Ksp��PbSO4����1.5��10��8��PbCl2��s����2Cl����aq��=PbCl42����aq��������˵���������
A. ����������Ǧ������������Դ�����úͷ�ֹ�ؽ�����Ⱦ
B. ������п���Ũ�������Ũ����
C. ����١��ڡ����о��漰���˲���
D. PbSO4��s����2Cl����aq��![]() PbCl2��s����SO42����aq����ƽ�ⳣ��Ϊ7.5��10��4
PbCl2��s����SO42����aq����ƽ�ⳣ��Ϊ7.5��10��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯�����ڹ�ҵ����������;�����������Ҫ�ɷ�ΪMg2B2O5��H2O��Fe3O4����������Fe2O3��FeO��CaO��Al2O3��SiO2��)Ϊԭ���Ʊ�����(H3BO3)�Ĺ���������ͼ��ʾ��
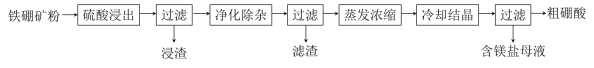
��֪������Ϊ��ĩ״���壬������ˮ�����ȵ�һ���¶ȿɷֽ�Ϊ��ˮ�
�ش��������⣺
��1��д��Mg2B2O5��H2O�����ᷴӦ�Ļ�ѧ����ʽ___��Ϊ��߽������ʣ����ʵ���������Ũ��Ũ���⣬���ɲ�ȡ�Ĵ�ʩ�У�д��������___��
��2�����������л�ʣ��������ǣ�___��д��ѧʽ����
��3�����������������ȼ�H2O2��Һ��������___��Ȼ���ٵ�����Һ��pHԼΪ5��Ŀ����___��
��4�������������е���Ҫ������___�������ƣ���
��5����������������ɾ������������������֡�������ͽ���þΪԭ�Ͽ��Ʊ��������û�ѧ����ʽ��ʾ�Ʊ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����(��Ҫ�ɷ�ΪTi3O5��������SiO2��FeO��Fe2O3)Ϊԭ���Ʊ���ɫ����TiO2��һ�ֹ����������£�
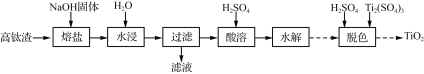
��֪��Na2TiO3�����ڼ�����Һ��H2TiO3�е�����Fe2����Fe3������ˮϴ��ȥ��
(1)����:
��Ϊ�ӿ췴Ӧ���ʣ���ά�ַ�Ӧ�������С����Ӧ�¶�һ���������£��ɲ�ȡ�Ĵ�ʩ��__________��
��NaOH������Ti3O5�ڿ����м�����500��550 ��ʱ����Na2TiO3���÷�Ӧ�Ļ�ѧ����ʽΪ_________��
(2)����:
�١���Һ������Ҫ����ΪNaOH������������________(�ѧʽ)��
�ڳ��Ӻ����Һ�л�õ�NaOH��ѭ�����ã���ˮ����ʱ����ˮ�����˹������Ҫԭ����_________��
(3)ˮ��:�����ܡ����õ�TiOSO4��������У�����������ˮ��H2TiO3���÷�Ӧ�Ļ�ѧ����ʽΪ______��
(4)��ɫ:H2TiO3�����������Fe(OH)3��Ӱ��TiO2��Ʒ����ɫ������ɫ��������Ti2(SO4)3��������_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com