
【题目】下列说法中:
①结构片段为…… ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚
②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应:![]()
⑤ 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有( )个。
A. 3 B. 4 C. 5 D. 6
【答案】B
【解析】高聚物是酚醛树脂,是由苯酚和甲醛通过缩聚反应生成,因此单体是甲醛和苯酚,故①正确;②HF在标准状况下不是气体,不能直接用22.4L·mol-1,故①错误;③甲醇是有毒的液体,甲醇的结构简式为CH3OH,只含有极性键,故③错误;④电离出H+能力是H2CO3>苯酚>HCO3-,因此苯酚与碳酸钠反应:![]() ,故④正确;⑤根据烯烃的命名,此有机物是2,4,4-三甲基-1-戊烯,故⑤正确;⑥3-甲基-1-丁烯的结构简式为CH2=CH-CH(CH3)2,因为甲烷的空间构型为正四面体,乙烯是平面结构,因此此有机物中所有碳原子不可能共面,故⑥正确;⑦苯燃烧的方程式为C6H6+15/2O2→6CO2+3H2O,苯甲酸燃烧的方程式:C7H6O2+15/2O2→7CO2+3H2O,等物质的量的两种物质燃烧消耗氧气的量相同,故⑦错误;综上所述,正确的有4个,故选项B正确
,故④正确;⑤根据烯烃的命名,此有机物是2,4,4-三甲基-1-戊烯,故⑤正确;⑥3-甲基-1-丁烯的结构简式为CH2=CH-CH(CH3)2,因为甲烷的空间构型为正四面体,乙烯是平面结构,因此此有机物中所有碳原子不可能共面,故⑥正确;⑦苯燃烧的方程式为C6H6+15/2O2→6CO2+3H2O,苯甲酸燃烧的方程式:C7H6O2+15/2O2→7CO2+3H2O,等物质的量的两种物质燃烧消耗氧气的量相同,故⑦错误;综上所述,正确的有4个,故选项B正确


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】实验室中用如图所示的原电池装置做电源电解足量的NaC1的酚酞溶液,X、Y均为惰性电极。下列有关说法不正确的是
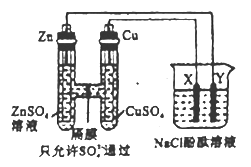
A. 原电池中SO42-通过隔膜从左向右移动
B. 反应一段时间后,烧杯中Y电极附近变红
C. Zn极质量减少6.5g时,X极理论上生成气体2.24L(标准状况)
D. 室温下,若Cu极质量增加1.6g时,此时烧杯溶液体积为500mL,则溶液的pH为13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相存性方面有很好的应用前景。 PPG的一种合成路线如下:

已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)由D和H生成PPG的化学方程式为: 。(3分)
(5)写出D的同分异构体中能同时满足下列条件的有机物结构简式: 。
①能与饱和NaHCO3溶液反应产生气体 ②既能发生银镜反应,又能发生水解反应③核磁共振氢谱显示为3组峰,且峰面积比为6:1:1
(6)D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_________(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的+1价离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法错误的是

A. X元素的原子序数是19 B. 该晶体中阳离子与阴离子个数比为3 : 1
C. X+离子是图中的黑球 D. X+的半径大于N3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2=NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)硫是一种重要的非金属元素,在自然界中以游离态和多种化合态形式存在。其中二氧化硫是主要的大气污染物之一。完成下列填空:
⑴火法炼铜中有如下反应:
Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH =-768.2 kJ·mol—1
Ⅱ:2Cu2O(s)+ Cu2S(s)=6Cu(s)+SO2(g) ΔH = +116.0 kJ·mol—1
①在反应Ⅱ中,只作氧化剂的是_________________(用化学式表示)。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的ΔH=______________________。
⑵工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,配平下列反应式:
______Mn2++______S2O82-+_____H2O = ______MnO4-+______SO42-+_____H+
⑶将SO2通入氯酸溶液中生成一种强酸和一种氧化物,已知反应掉1.5mol氯酸时转移了9.03×1023个电子,写出该反应的化学方程式_______________________________。
(二)为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
⑴已知2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-476.5kJ·mol-1;
将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。

①CO在0-9min内的平均反应速率v(CO)=_______mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
⑵通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-1的HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,与NaCl晶体结构相似。晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法正确的是
A. 晶体中与每个K+距离最近的K+有6个
B. 晶体中每个K+周围有8个O2-,每个O2-周围有8个K +
C. 超氧化钾的化学式为KO2,每个晶胞含有14个K+和13个O2-
D. 晶体中,0价氧原子与-2价氧原子的数目比可看作为3 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是

A. A、B两种酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液的酸性弱
C. 若a=4,则A是强酸,B是弱酸
D. 若1<a<4,则A、B都是弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com