


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| B、点燃这种液体,然后再观察火焰的颜色 |
| C、先加足量溴水,然后再加入酸性高锰酸钾溶液 |
| D、加入浓硫酸与浓硝酸后加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D、凡含有食品添加剂的食物对人体健康均有害,不可食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
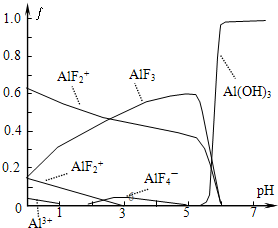 氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极只析出H2 |
| B、阳极先析出Cl2,后析出O2 |
| C、电解最后阶段为电解水 |
| D、溶液pH不断增大,最后为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com