
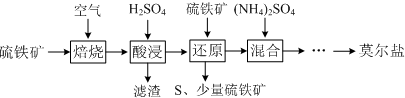
| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
分析 硫铁矿(主要含FeS2、SiO2等)在空气中焙烧,得二氧化硫气体和氧化铁、二氧化硅等固体,加硫酸溶解,过滤除去二氧化硅,得硫酸铁溶液,硫酸铁溶液中再加入硫铁矿,FeS2把铁离子还原为Fe2+,同时生成S沉淀,过滤,滤渣含有S、硫铁矿,滤液中主要含有硫酸亚铁的混合溶液,向混合溶液中加入硫酸铵,经过蒸发浓缩降温结晶,过滤,洗涤,干燥可得莫尔盐,
(1)铁离子水解显酸性,pH过高促进水解;“还原”时反应Ⅱ生成亚铁离子、硫酸根离子;
(2)由表中数据可知,反应后硫酸根的浓度比反应前增加了3.50mol•L-1-3.20mol•L-1=0.3mol•L-1,根据反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+可知,反应中消耗Fe3+的物质的量为2.1mol,生成的Fe2+物质的量为2.25mol,由于Ⅰ、Ⅱ中被还原的Fe3+的物质的量之比为2:7,Ⅰ中消耗的铁离子的物质的量为0.6mol,再结合反应2Fe3++FeS2=2S↓+3Fe2+计算生成Fe2+物质的量;
(3)称取23.52g新制莫尔盐,溶于水配成溶液并分成两等份,一份加入足量的BaCl2溶液,得到白色沉淀硫酸钡的质量为13.98g,其物质的量为$\frac{13.98g}{233g/mol}$=0.06mol,所以n(SO42-)=0.06mol,
另一份用0.2000mol•L-1K2Cr2O7酸性溶液滴定,当Cr2O72-恰好完全被还原为Cr3+时,消耗溶液的体积为25.00mL,根据题意,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) 0.2000mol•L-1×0.025L,
所以n(Fe2+)=0.005 mol×6=0.03mol,
根据电荷守恒:n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.06mol,再计算n(H2O),由物质的量比确定化学式.
解答 解:(1)溶液里的Fe3+或Fe2+易水解,还原”时时,pH过高会促进Fe3+或Fe2+水解生成沉淀,故不易太高;“还原”时反应Ⅱ的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,
故答案为:pH过高时铁元素将沉淀导致产率降低;FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+;
(2)假设溶液体积为1L,根据表可知,反应Ⅱ中生成的硫酸根的物质的量为(3.50 mol•L-1-3.20mol•L-1)×1L=0.3mol,据反应FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+可知,反应Ⅱ中被还原的Fe3+的物质的量为2.1mol,同时计算出生成的亚铁离子的物质的量为2.25mol,反应Ⅰ、被还原的Fe3+的物质的量为0.6mol,同时计算出生成的亚铁离子的物质的量为0.9mol,溶液中增加的亚铁离子的物质的量浓度为$\frac{0.9mol+2.25mol}{1L}$=3.15mol•L-1,则还原后Fe2+的物质的量浓度为0.15mol•L-1+3.15mol•L-1=3.30mol•L-1,
故答案为:3.30;
(3)根据题意,白色沉淀的物质的量为$\frac{13.98g}{233g/mol}$=0.06moln(SO42-)=0.06mol,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) 0.2000mol•L-1×0.025L,
所以n(Fe2+)=0.005 mol×6=0.03mol,
根据电荷守恒:n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.06mol,
n(H2O)=$\frac{\frac{25.52g}{2}-0.06mol×96g/mol-0.03mol×56g/mol-0.06mol×18g/mol}{18g/mol}$=0.18 mol,
所以n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0.06mol:0.03mol:0.06mol:0.18mol=2:1:2:6,所以莫尔盐的化学式为(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O],
答:莫尔盐的化学式为(NH4)2Fe(SO4)2•6H2O.
点评 本题考查物质的制备实验,为高频考点,把握物质的性质、制备原理、化学计算技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、Cl-、AlO2- | B. | Al3+、Na+、NO3-、HCO3- | ||
| C. | NH4+、Fe3+、SO42-、NO3- | D. | Ca2+、H+、NO3-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com