
【题目】铬是广泛存在于环境中的金属元素,在水体中主要以三价和六价铬的化合物为主,其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为:
![]()
请回答下列问题:
I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) = v (CrO42-) c.溶液的颜色保持不变
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O K=5×1014
Cr2O72-(橙色)+H2O K=5×1014
若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转:Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O
2CrO42-(黄色) +H2O
设该反应的平衡常数为K1,则K1=_______________。
II.为进一步研究初始pH和草酸浓度对第②步反应速率的影响,某学习小组设计对比实验如下表:
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
甲 | 4 | 60 | 10 | 30 |
乙 | 5 | x | 10 | 30 |
丙 | 5 | y | 5 | z |
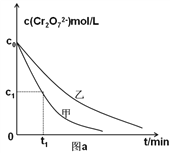
(3)实验设计表中z=_______mL;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=________mol/(L·min) (用含字母的代数式表示)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
【答案】 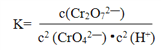 c 2×1013 35 2(c0-c1)/t1 5(或≥5)
c 2×1013 35 2(c0-c1)/t1 5(或≥5)
【解析】I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,该反应的平衡常数表达式为
Cr2O72-(橙色)+H2O,该反应的平衡常数表达式为 。第①步反应的下列状态中:a.Cr2O72-和CrO42-的浓度相同,不能说明它们的浓度保持不变;b.2v (Cr2O72-) = v (CrO42-) 不能代表正反应速率与逆反应速率相等;c.溶液的颜色保持不变,说明反应混合物中各组分的浓度均保持不变,即达到平衡状态。综上所述,一定达到平衡的是c。
。第①步反应的下列状态中:a.Cr2O72-和CrO42-的浓度相同,不能说明它们的浓度保持不变;b.2v (Cr2O72-) = v (CrO42-) 不能代表正反应速率与逆反应速率相等;c.溶液的颜色保持不变,说明反应混合物中各组分的浓度均保持不变,即达到平衡状态。综上所述,一定达到平衡的是c。
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O ,K=5×1014;若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转为Cr2O72-(橙色) +2OH-
Cr2O72-(橙色)+H2O ,K=5×1014;若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转为Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O,设该反应的平衡常数为K1,则K1=
2CrO42-(黄色) +H2O,设该反应的平衡常数为K1,则K1=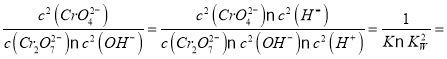 2×1013。
2×1013。
II.(3)根据控制变量法的原理可知,要保证废水样品相同、混合后总体积相同,即x=60、y=60,所以实验设计表中z=35;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=2 v(Cr2O72-)=![]() mol/(L·min)。
mol/(L·min)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,则
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,则![]() ,即c(OH-)≥10-9mol/L,所以溶液的pH应调至5(或≥5)。
,即c(OH-)≥10-9mol/L,所以溶液的pH应调至5(或≥5)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】结合所学内容回答下列问题:
Ⅰ.某实验小组以H2O2的分解为例,研究浓度、催化剂、温度对化学反应速率的影响,按照如下方案设计实验。
实验编号 | 反应物 | 催化剂 | 温度 |
① | 10 mL 2% H2O2溶液 | 无 | 20℃ |
② | 10 mL 5% H2O2溶液 | 无 | 20℃ |
③ | 10 mL 5% H2O2溶液 | 1-2滴1 mol/LFeCl3溶液 | 20℃ |
④ | 10 mL 5% H2O2溶液 | 无 | 20℃ |
⑤ | 10 mL 5% H2O2溶液 | ||
⑥ | 无 | 20℃ |
(1)实验①和②的目的是研究_______________对反应速率的影响。
(2)实验③和④测得生成氧气的体积随时间变化的关系如下图所示。
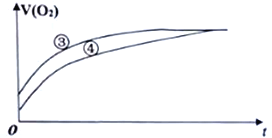
分析上图能够得出的实验结论是________________________________________________。
(3)实验⑤和⑥是研究温度相差10℃对反应速率的影响,请在上面表格空白处补齐对应的内容_________。
Ⅱ.某温度时,在2L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
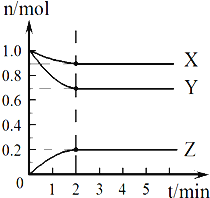
(4)反应开始至2 min,Z的平均反应速率____________。
(5)保持容器容积不变,在第2min时改变下列条件时,化学反应速率的变化是:
①向其中充入1 molX气体,化学反应速率_______(填 “加快”“减慢”或“不变”,下同);
②向其中充入1 mol N2(g) (N2不参加反应),化学反应速率_______________;
③同时加入0.9molX、0.7molY 和0.2molZ,化学反应速率________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鸦片最早用于药物(有止痛、止泻、止咳的作用),长期服用会成瘾,使人体质衰弱,精神颓废,寿命缩短.鸦片具有复杂的组成,其中的罂粟碱的分子结构如下: 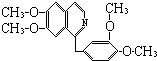 已知该物质的燃烧产物为CO2、H2O和N2 , 1mol该化和物完全燃烧消耗的O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物的同分异构体的种数分别为( )
已知该物质的燃烧产物为CO2、H2O和N2 , 1mol该化和物完全燃烧消耗的O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物的同分异构体的种数分别为( )
A.23.25mol 5
B.24.5mol 7
C.24.5mol 8
D.23.25mol 6
查看答案和解析>>
科目:高中化学 来源: 题型:
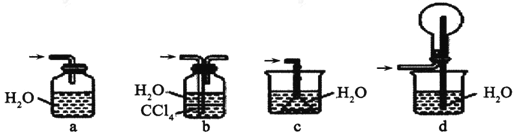
【题目】氨气是一种重要化合物,在工农业生产、生活中有重要作用。利用下图探究氨气的性质。
(1)收集气体,按下图玻璃装置进行实验。先打开旋塞①,B瓶中产生白色的烟,原因是______(用化学方程式表示);稳定后,关闭旋塞①,再打开旋塞②,B瓶中的现象是________。

(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________,该反应生成的还原产物的化学键类型是________。
(3)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):

①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是_______。
②C装置中发生反应的化学方程式为________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是______,试设计实验证明这种离子的存在________。
④下列哪些装置可以同时起到装置D和E的作用_______ (填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是
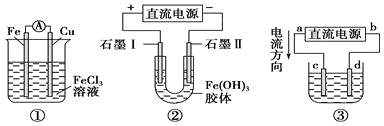
A. 装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B. 装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C. 装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D. 若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是实验操作,能达到实验目的是( )
A. 用25.00mL碱式滴定管量取14.80mLNaOH溶液
B. 用100mL量筒量取5.2mL盐酸
C. 用托盘天平称取25.20g氯化钠
D. 用100mL容量瓶配制50mL0.1mol·L-1盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝等金属单质及其化合物在生产和生活中有着广泛的应用。
(1)金属冶炼与处理常涉及氧化还原反应,由下列物质冶炼相应金属单质时采用电解法的是_________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述_______(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为______________________________________________。
(3)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时负极反应式为_____________。
(4)氨气也可作为燃料电池的燃料源制成高效率无污染的燃料电池系统,总反应式为:![]() (未配平),写出此碱性燃料电池的负极反应式:_______。
(未配平),写出此碱性燃料电池的负极反应式:_______。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_________________________。
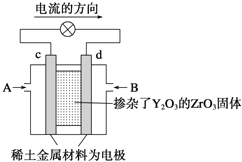
(6)科学家制造出一种使用固体电解质的燃料电池,其效率高无污染,多用于航天航空。如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-),d电极上的电极反应式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型电池的工作原理如图所示,放电时总反应为:Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2,下列说法错误的是

A. 放电时,正极的电极反应式为NiO(OH)+e-+H2O=Ni(OH)2+OH-
B. 充电时,阳极的电极反应式为AlO2--3e-+2H2O=A1+4OH-
C. 放电时,Na+向正极移动
D. 充电时,当电路中通过3NA电子时,阳极质量减少3g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com