
| A. | CuCl2+2NaOH═Cu(OH)2↓+2NaCl Cu2++2OH-═Cu(OH)2↓ | |
| B. | BaCO3+2HCl═BaCl2+CO2↑十H2O CO${\;}_{3}^{2-}$十2H+═CO2↑十H2O | |
| C. | CaCl2+Na2CO3═CaCO3↓+2NaCl Ca2++CO${\;}_{3}^{2-}$═CaCO3↓ | |
| D. | 2NaOH+H2SO4=Na2SO4十2H2O H++OH-═H2O |
分析 A.CuCl2+2NaOH═Cu(OH)2↓+2NaCl 反应实质是铜离子与氢氧根离子生成氢氧化铜沉淀;
B.碳酸钡为沉淀,应保留化学式;
C.CaCl2+Na2CO3═CaCO3↓+2NaCl 反应的实质是钙离子与碳酸根离子生成碳酸钙沉淀;
D.2NaOH+H2SO4=Na2SO4十2H2O 反应的实质是氢离子与氢氧根离子生成水.
解答 解:A.CuCl2+2NaOH═Cu(OH)2↓+2NaCl 反应实质是铜离子与氢氧根离子生成氢氧化铜沉淀,离子方程式:Cu2++2OH-═Cu(OH)2↓,故A正确;
B.BaCO3+2HCl═BaCl2+CO2↑十H2O反应的离子方程式:BaCO3+2H+═CO2↑十H2O+Ba2+,故B错误;
C.CaCl2+Na2CO3═CaCO3↓+2NaCl 反应的实质是钙离子与碳酸根离子生成碳酸钙沉淀,离子方程式:Ca2++CO32-═CaCO3↓,故C正确;
D.2NaOH+H2SO4=Na2SO4十2H2O 反应的实质是氢离子与氢氧根离子生成水,离子方程式:H++OH-═H2O,故D正确;
故选:B.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意化学式的拆分,题目难度不大.


科目:高中化学 来源: 题型:解答题
 AX(g)+2X2(g)?AX5(g)在容积为10L恒定不变的密闭容器中进行.起始时AX和X2均为1.3mol.分三组进行实验,每组只改变一个条件且改变条件均不同.反应体系总压强随时间的变化如图所示.(计算结果均保留两位有效数字)
AX(g)+2X2(g)?AX5(g)在容积为10L恒定不变的密闭容器中进行.起始时AX和X2均为1.3mol.分三组进行实验,每组只改变一个条件且改变条件均不同.反应体系总压强随时间的变化如图所示.(计算结果均保留两位有效数字)查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓盐酸检验氨:NH3+HCl═NH4Cl | |
| B. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2═2Na2O | |
| C. | Na2O2在潮湿空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K与L形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| B. | 根据非金属性强弱,不可能由Z的最高价氧化物制出W的最高价氧化物 | |
| C. | L的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| D. | 向两份BaCl2溶液中分别通入RL2、WL2,均无白色沉淀生成,但一段时间后,通入RL2的一份中可能产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以下说法正确的是( )
以下说法正确的是( )| A. | ③④⑥ | B. | ①②③ | C. | ④⑤⑥ | D. | ①③④⑤⑥⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 s末氨气的反应速率=0.4 mol•(L•s)-1 | |
| B. | 前2 s时间内氢气的平均反应速率=0.9 mol•(L•s)-1 | |
| C. | 前4 s时间内氮气的平均反应速率=0.1mol•(L•s)-1 | |
| D. | 2~4 s时间内氨气的平均反应速率=0.2 mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .写出A与溴水的反应方程式
.写出A与溴水的反应方程式 +3Br2→
+3Br2→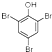 ↓+3HBr
↓+3HBr 或
或 (任写一个).
(任写一个). .
. 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com