
分析 (1)根据物质的量n=$\frac{m}{M}$来求算硫酸的物质的量;质量m=nM;硫酸分子中含2个H原子和4个O原子;
(2)①一种物质的摩尔质量在数值上等于该物质的相对分子质量;
②根据分子个数可求出气体的物质的量n=$\frac{N}{{N}_{A}}$,而物质的摩尔质量M=$\frac{m}{n}$,据此分析.
解答 解:(1)49g硫酸的物质的量n=$\frac{m}{M}$=$\frac{49g}{98g/mol}$=0.5mol;
1.5mol硫酸的质量m=nM=1.5mol×98g/mol=147g,由于硫酸分子中含2个H原子和4个O原子,故1.5mol硫酸中含3molH原子和6mol氧原子,故含有的氧原子的质量m=nM=6mol×16g/mol=96g.
故答案为:0.5mol;147g;3;96.
(2)①一种物质的摩尔质量在数值上等于该物质的相对分子质量,单位为g/mol,故NH3的分子量为17,则NH3的摩尔质量为17g/mol,
故答案为:17g/mol;
②由于气体中含b个分子,故气体的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{b}{{N}_{A}}$mol,而质量为ag,则该气体的摩尔质量M=$\frac{m}{n}$=$\frac{ag}{\frac{b}{{N}_{A}}mol}$=$\frac{a{N}_{A}}{b}$g/mol.故答案为:$\frac{a{N}_{A}}{b}$g/mol.
点评 本题考查了阿伏伽德罗常数和物质的量、摩尔质量的有关计算,难度不大,熟练掌握公式的运用是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 铯与水反应比钠更加剧烈 | |
| B. | 原子最外层都只有一个电子 | |
| C. | 锂燃烧生成Li2O | |
| D. | 钾可以将氯化钠溶液中的钠置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
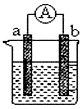 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 5 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | HCl溶液 | C. | CuSO4溶液 | D. | NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+>Fe2+>Zn2+ | B. | 还原性:Fe3+>Cu2+>Fe2+>Zn2+ | ||
| C. | 氧化性:Zn>Fe>Cu>Fe2+ | D. | 还原性:Zn>Fe>Cu>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
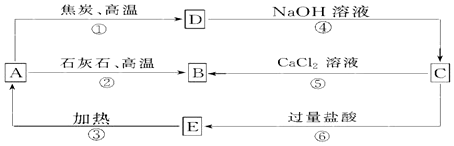
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和水反应2Na+H2O═2Na++OH-+H2↑ | |
| B. | 氯化镁溶液加入氨水:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO | |
| D. | 氢氧化钡与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com