

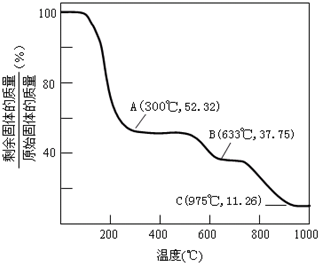
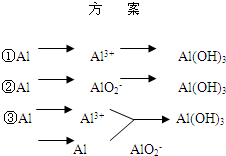
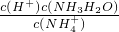 ;
;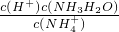 ;
; NH3↑+3H2O+NaAlO2+2Na2SO4
NH3↑+3H2O+NaAlO2+2Na2SO4 NH3↑+3H2O+NaAlO2+2Na2SO4;
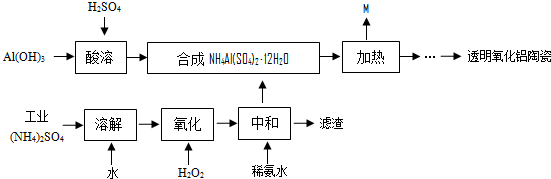
NH3↑+3H2O+NaAlO2+2Na2SO4;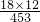 ×100%≈52.32%,大于这个值,说明结晶水没有完全失去;
×100%≈52.32%,大于这个值,说明结晶水没有完全失去;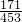 ×100%≈37.75%;当比值大于37.75%时,硫酸铵没有完全分解,当等于这个比值,说明硫酸铵恰好分解完全,小于这个比值,硫酸铝开始分解;故B点剩余固体是硫酸铝;
×100%≈37.75%;当比值大于37.75%时,硫酸铵没有完全分解,当等于这个比值,说明硫酸铵恰好分解完全,小于这个比值,硫酸铝开始分解;故B点剩余固体是硫酸铝; NH3↑+3H2O+NaAlO2+2Na2SO4;
NH3↑+3H2O+NaAlO2+2Na2SO4;

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
 实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/mol | |||||
| 消耗H+ | 消耗OH- | |||||
| ① | 3 | 3 3 | ||||
| ② | 1 1 |
1 | ||||
| ③ | 3/4 |
| ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?c(NH3?H2O) |
| c(NH4+) |
| c(H+)?c(NH3?H2O) |
| c(NH4+) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
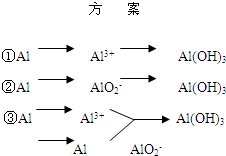 实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/mol | |
| 消耗H+ | 消耗OH- | |
| ① | 3 | ______ |
| ② | ______ | 1 |
| ③ | 3/4 | ______ |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年河南省南阳市南召二中高三(上)期末化学模拟试卷(解析版) 题型:解答题
| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/mol | |
| 消耗H+ | 消耗OH- | |
| ① | 3 | ______ |
| ② | ______ | 1 |
| ③ | 3/4 | ______ |
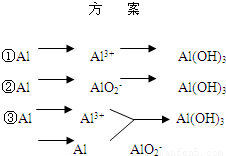
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com