
【题目】已知硫酸溶液的密度大于水。将mg 质量分数为a%、物质的量浓度为c1mol/L的稀硫酸加热蒸发掉m/2g水,此时溶质的质量分数变为b%,物质的量浓度为c2 mol/L,下列关系正确的是
A. b<2a B. c2<2c1 C. c2>2c1 D. c2=2c1
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物。常温时,0.1mol·L-1的a溶液的pH为1, d为红棕色气体,e为无色气体。下列说法正确的是

A. 元素的非金属性:Y>Z>X
B. 反应①中消耗lmola时转移电子数与反应②中生成1mol a时转移电子数相等
C. 原子半径的大小:Y<Z<W
D. Y的氢化物常温常压下为气态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2中的物质补充到图1中,可得到一个完整的氧化还原反应离子方程式(未配平)。

对该氧化还原反应的离子方程式,说法不正确的是
A.![]() 作氧化剂,具有氧化性
作氧化剂,具有氧化性
B.氧化性:![]() >
>![]()
C.氧化剂和还原剂的物质的量之比为5∶2
D.若有2 mol Mn2+参加反应,则转移10 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:

已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.0×10-33 | 4.0×10-38 | 2.0×10-20 | 4.0×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)(NH4)2S的电子式为________________;“净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。
据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。

(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
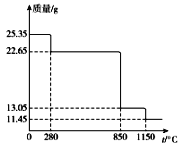
①300℃时,所得固体的化学式为______________________。
②1150℃时,反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同学们请游爷爷讲述抗战故事,爷爷打开一个珍藏的箱子,拿出一件粗棉布军装、一把黄铜军号、一副玻璃眼镜和一本记有烈士名单的塑料封皮笔记本,给同学们讲述了当年的惨烈战事。下列说法不正确的是( )
A. 棉是天然高分子材料 B. 黄铜是合金
C. 塑料是合成高分子材料 D. 玻璃是合成纤维材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学--选修5:有机化学基础】
以A(C8H18O)为主要原料,合成高分子化合物M、N的一种路线如下:

已知:①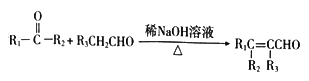 (R1、R2、R3表示烃基或氢原子)
(R1、R2、R3表示烃基或氢原子)
②![]() (R表示烃基或氢原子)
(R表示烃基或氢原子)
③ (R和R′表示烃基或H原子)
(R和R′表示烃基或H原子)
请回答:
(1)A的结构简式为________________。
(2)B的化学名称为_____________;E中含氧官能团的名称为___________________。
(3)C分子中最多有______________个原子在同一平面上。
(4)B→N的反应类型为_______________。
(5)F→M的化学方程式为________________。
(6)W是F的同系物,比F少一个碳原子。同时满足下列条件的W的同分异构体有______种(不考虑立体异构)。
①苯环上连接两个取代基; ②能与NaHCO3溶液反应放出CO2;
③能发生银镜反应。
W的所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是________(填选项字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(7)参照上述合成路线和信息,以甲醛、乙醛和三氯甲烷为原料(无机试剂任选),设计制备 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g) + H2O(g)==CO(g)+3H2(g) △H1
已知:
①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O(l) =H2O(g) △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
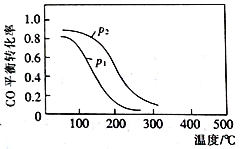
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如右图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________(填“>”“<”或“ = ”)0。
②写出两条可同时提高反应速率和CO转化率的措施:________________________ 。
③下列说法正确的是____________(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
C.容器内气体压强不再变化时,反应达到最大限度
D.图中压强p12
④03 min内用CH3OH表示的反应速率v(CH3OH)=_________mol L-1·min-1。
⑤200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1 mol·L-1H2R(二元弱酸)溶液中滴加0.1 mol·L-1NaOH溶液,溶液PH与加入NaOH溶液体积的关系如图所示。下列有关说法正确的是

A. a点所示溶液中: c(H2R) + c (HR-) +c (R2-)=0.1 mol·L-1
B. b点所得溶液中: c (H2R) + c (H+)= c (HR-) + c (OH-)
C. c点所得溶液中: c (HR-)= c (R2-)
D. a、b、c、d中,d点所示溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双隔膜电解池(两电极均为惰性电极)的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断错误的是

A. 如电极材料均改为铜板,电解池的总反应方程式不变
B. 向A溶液中滴加石蕊试液显红色
C. c隔膜为阴离子交换膜、d隔膜为阳离子交换膜
D. 相同条件下,c隔膜附近电极产生的a气体与d隔膜附近电极产生的b气体体积比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com