
 2A1C13+3CO,
2A1C13+3CO, 2A1C13+3CO;
2A1C13+3CO;
 ×100%=96%,
×100%=96%,

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南京市四校高三12月月考化学试卷 题型:填空题
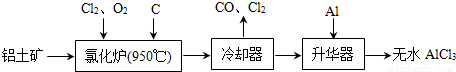
(14分)无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。

(1)氯化炉中Al2O3、C12和C反应的化学方程式为 ▲ 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 ▲ 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 ▲ 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 ▲ 、 ▲ 。
②AlCl3产品的纯度为 ▲ 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com