
| A. | 镁片与稀硫酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
分析 存在元素的化合价变化的反应为氧化还原反应,常见的吸热反应有:Ba(OH)2•8H2O与NH4Cl反应、大多数的分解反应、C(或氢气)参加的氧化还原反应等,以此来解答.
解答 解:A.Mg与稀H2SO4反应,有化合价的变化属于氧化还原反应,但属于放热反应,故A错误;
B.Ba(OH)2•8H2O与NH4Cl的反应为吸热反应,但不是氧化还原反应,故B错误;
C.灼热的炭与CO2反应,有化合价的变化属于氧化还原反应,且属于吸热反应,故C正确;
D.甲烷在O2中的燃烧反应,有化合价的变化属于氧化还原反应,但属于放热反应,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,侧重反应类型判断的考查,注意化合价角度及归纳常见的吸热反应分析,题目难度不大.


科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl3固体放入水中搅拌 | |
| B. | 向FeCl3溶液中加入NaOH溶液 | |
| C. | 加热FeCl3溶液 | |
| D. | 向沸水中滴加饱和FeCl3溶液,并加热至红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
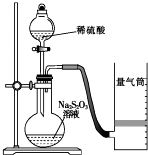 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁作负极 | |
| B. | 正极材料可以是石墨 | |
| C. | 电解质可以是CuSO4溶液 | |
| D. | 0.2mol电子通过电解质移动向正极被0.2molCu2+得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
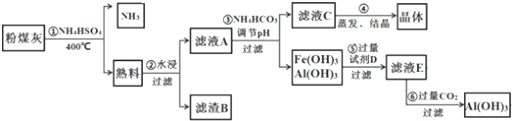
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com