
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
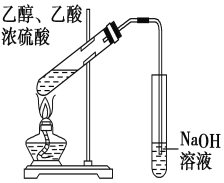
(1)写出制取乙酸乙酯的化学反应方程式 。
(2)浓硫酸的作用是: 。
(3)实验装置图有明显错误,请指出错误是 。
(4)实验中可以观察到的现象是________________________ _____________ 。
(5) 写出把制得的乙酸乙酯分离出来所需的试剂和方法 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,
就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
②单位时间里,生成1mol乙酸乙酯,同时生成1mol水
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④混合物中各物质的浓度不再变化
【答案】(1)CH3COOH + C2H5OH![]() CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
(2)①催化剂;②吸水剂
(3)导管伸入液面下,使用NaOH溶液作为洗涤液
(4)试管中的液体分层,上层是透明的油状液体
(5)加入饱和的Na2CO3,振荡,静置,分液
(6)①④
【解析】
试题分析:(1)酯化反应的本质为酸脱羟基,醇脱氢生成酯和水,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。
故答案为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)乙酸与乙醇发生酯化反应,需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动。所以,浓硫酸的作用为催化剂,吸水剂。
故答案为:催化剂;吸水剂;
(3)该装置中右侧试管中导管插入液面以下会引起液体倒吸;用氢氧化钠溶液接收乙酸乙酯会造成乙酸乙酯碱性水解,最终得不到乙酸乙酯,应该用饱和碳酸钠溶液。
故答案为:导管伸入液面下;使用NaOH溶液作为洗涤液;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液中和挥发出来的乙酸,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,使乙酸乙酯分层析出,由于乙酸乙酯的密度小于1,所以实验中会看到试管中的液体分层,上层是透明的油状液体。
故答案为:试管中的液体分层,上层是透明的油状液体;
(5)分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯。
故答案为:分液。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,当正逆反应速率相等、反应混合物中各物质含量不变时,就达到了该反应的限度,也即达到化学平衡状态。①单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,说明正逆反应速率相等,反应达到了平衡状态,故正确;②单位时间里,生成1mol乙酸乙酯,同时生成1mol水均是正反应方向,不能说明正逆反应速率相等,故错误;③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸均是正反应方向,不能说明正逆反应速率相等,故错误;④混合物中各物质的浓度不再变化,说明正逆反应速率相等,反应达到了平衡状态,故正确。因此,能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有①④。
故答案为:①④。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
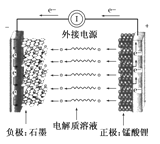
【题目】通常氢氧燃料电池有酸式和碱式两种,试回答下列问题:
(1)在酸式介质中,负极反应的物质为 ,正极反应的物质为 ,酸式电池的电极反应:
负极: ,正极: 。
电解质溶液pH的变化 (填“变大”,“变小”,“不变”)。
(2)在碱式介质中,碱式电池的电极反应:
负极: ,正极: 。
电解质溶液pH的变化 (填“变大”,“变小”,“不变”)。
(3)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是________。
A.太阳光催化分解水制氢气比电解水气氢气更为科学
B.氢氧燃料电池作为汽车动力更能保护环境
C.以稀H2SO4、KOH为介质的氢氧燃料电池的负极电极反应式相同
D.以稀H2SO4、KOH为介质的氢氧燃料电池的总反应式相同
(4)纯电动车采用了高效耐用的一种新型可充电电池,该电池的总反应式为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH。
3Zn(OH)2+2Fe(OH)3+4KOH。
①该电池放电时负极反应式为_________________。
②放电时每转移3 mol电子,正极有________ mol K2FeO4被还原。
锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位。
电池反应式为:Li1-xMnO4+Lix ![]() LiMnO4,下列有关说法不正确的是________。
LiMnO4,下列有关说法不正确的是________。
A.放电时电池的正极反应式为:Li1-xMnO4+xLi++xe-===LiMnO4
B.放电过程中,石墨没有得失电子
C.该电池也能在KOH溶液的环境中正常工作
D.充电时电池上标有“-”的电极应与外接电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
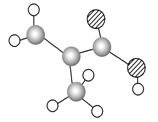
(1)该物质的结构简式为________________.
(2)该物质中所含官能团的名称为______________.
(3)下列物质中,与该产品互为同系物的是(填序号)__________,互为同分异构体的是____________.
①CH3CH===CHCOOH ②CH2===CHCOOCH3 ③CH3CH2CH===CHCOOH
④CH3CH(CH3)COOH ⑤CH2===CHCOOH
(4)该物质在一定条件下发生加聚反应的化学方程式为__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的位置如表所示。下列说法中,正确的是( )
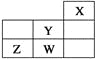
A. W的最高价氧化物对应的水化物是强酸
B. Y的原子半径在同周期主族元素中最大
C. 还原性:W->Z2-
D. Z的气态氢化物的稳定性在同主族元素中最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-═NO↑+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的化学方程式__________________________________;
(2)反应中硝酸体现了__________、______;
(3)反应中若产生标准状况下11.2L气体,则转移电子的物质的量是__________;
(4)现称取含有杂质的甲样品(杂质与酸不反应)5.4g,恰好与100mL 1.4mol/L的硝酸溶液完全反应,则该样品的纯度为__________;
(5)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2,6-二甲基-4-乙基庚烷的结构简式是______________________,其一氯代物有_________种。
(2)按系统命名法下列有机物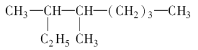 的名称是______________。
的名称是______________。
(3)某化合物的分子式为C5H11Cl,其核磁共振氢谱图中显示三种峰且面积之比为6:4:1,则该物质的结构简式为______ _;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。已知,相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,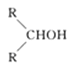 最难。
最难。
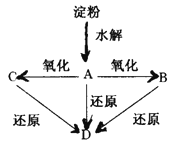
请回答下列问题:
(1)请在下列横线上填写A、B、C、D的结构简式。
A: ;B: ;C: ;D: 。
(2)写出下列反应的化学方程式。
淀粉→A:
A→D:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为
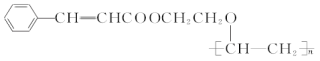 。按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到。
。按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到。
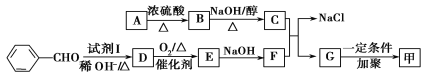
已知:
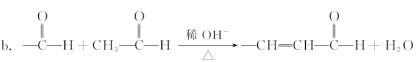
a.—CH2OH + —CH2OH![]() —CH2OCH2— + H2O
—CH2OCH2— + H2O
请回答下列问题:
(1)质谱图显示A的相对分子质量是80.5,A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积之比为2∶2∶1,则A的结构简式为_______________________________________。
(2)试剂I的名称是__________________;B→C的反应类型是__________________。
(3)写出下列反应的化学方程式:
①D→E___________________________________________________________________;
②C+F→G+NaCl_________________________________________________________。
(4)E的一种同分异构体的水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com