
 实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:
实验室要用Na2CO3?10H2O晶体配制500mL 0.1mol?L-1 Na2CO3溶液,回答下列问题:| nB |
| V |
| nB |
| V |
| nB |
| V |
| nB |
| V |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省温州市十校联合体高一(上)期中化学试卷(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:
(7分)实验室要用Na2CO3?10H2O晶体配制500mLO.1 mol?L-1Na2CO3溶液,回答下列问题:

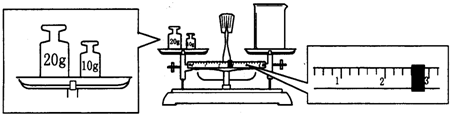
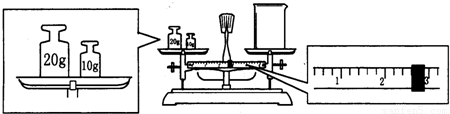
(1)应该用托盘天平称取Na2CO3?10H2O g。
(2)右翻I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为8,量筒中液体的体积是 mL。
(3)若实验中右图II所示的仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.定容前容器底部有水珠 ;
B.定容时加水超过刻度线 ;
C.最终定容时俯视观察液面 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com