
| A. | Fe和Cl2恰好完全反应 | B. | 生成99gFeCl3 | ||
| C. | 会有9.33gFe过量 | D. | 会有17.75gCl2过量 |
分析 计算28gFe和71gCl2的物质的量,根据2Fe+3Cl2$\stackrel{△}{→}$2FeCl3判断二者恰好反应还是某一种过量.
解答 解:n(Fe)=$\frac{28g}{56g/mol}$=0.5mol,n(Cl2)=$\frac{71g}{71g/mol}$=1mol,$\frac{n(Fe)}{n(C{l}_{2})}$=$\frac{0.5mol}{1mol}$=$\frac{1}{2}$<$\frac{2}{3}$,因此Cl2过量,
设反应生成FeCl3的物质的量为xmol,消耗Cl2的物质的量为有mol,则
2Fe+3Cl2$\stackrel{△}{→}$2FeCl3
2 3 2
0.5 x y
$\frac{2}{0.5}=\frac{3}{x}=\frac{2}{y}$,解得x=0.75,y=0.5,
因此生成FeCl3的质量为0.5mol×162.5g/mol=81.25g,
剩余Cl2的质量为(1-0.75)mol×71g/mol=17.75g,
故选D.
点评 本题考查了过量计算,能够根据反应物的物质的量和化学方程式中化学计量数的比例关系判断那种反应物过量是解题的关键,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去水垢:${CO}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用惰性电解电解氯化镁溶液:Mg2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3- | |
| D. | 碳酸氢钠溶液显碱性:${HCO}_{3}^{-}$+H2O?H2CO3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
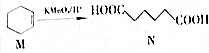 .下列说法错误的是( )
.下列说法错误的是( )| A. | M的分子式为C6H10 | |
| B. | M中所有碳原子在同一平面上 | |
| C. | N能发生氧化反应和取代反应 | |
| D. | N的含有相同官能团的同分异构体有8种(不考虑立体异构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡C一CH2CH3 丁炔 | B. | CH2=CH-CH=CH-CH3 1,3-二戊烯 | ||
| C. | 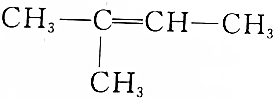 2-甲基丁烯 | D. | 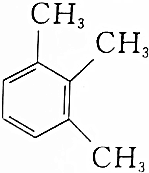 1,2,3-三甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热蒸发食盐水可以得到 NaCl 晶体,加热蒸发 AlCl 3 溶液也可以得到 AlCl 3 晶体 | |
| B. | 配制浓度均为 0.1mol•L-1 的H3PO4 和 H2SO4 溶液,分别测其pH,若 H3PO 4溶液的pH大于 H2SO4 溶液的pH,可推出非金属性:S>P | |
| C. | NaHCO3 溶液中滴入酚酞显红色,NaHSO4 溶液中滴入酚酞也显红色 | |
| D. | 钠在氧气中燃烧生成过氧化钠,和钠同主族的锂在氧气中燃烧也生成过氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
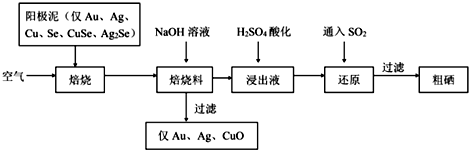
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 | |
| B. | 室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 | |
| C. | 室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 | |
| D. | 相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com