
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ②④⑥ |
分析 ①不同物质组成的为混合物,同种物质组成的为纯净物;
②不同元素组成的纯净物为化合物;
③水溶液中或熔融状态下导电的化合物为电解质;
④同种元素组成的不同单质为同素异形体;
⑤结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物;
⑥分子式相同,结构不同的化合物互称为同分异构体.
解答 解:①盐酸为氯化氢水溶液、漂白粉是氯化钙和次氯酸钙混合物、水玻璃是硅酸钠水溶液属于混合物,水银是金属汞属于纯净物中的单质,故①错误;
②氯化钙、氢氧化钠、HCl都是化合物、HD使氢元素的单质,不是化合物,故②错误;
③明矾、石膏、冰醋酸、石炭酸都能在水溶液里电离出自由移动的离子,是电解质,故③正确;
④C60、C70、金刚石、石墨烯 是碳元素的不同单质是碳元素的同素异形体,故④正确:
⑤CH2O2、C2H4O2、C3H6O2、C4H8O2分子组成相差CH2,但结构不一定相似,可能为酸、酯、羟基醛等不一定为同系物,故⑤错误;
⑥乙二酸二乙酯是分子式:C6H10O4,乙二酸乙二酯二乙酯是分子式:C6H4O4,二乙酸乙二酯二乙酯是分子式:C6H10O4.分子式不相同,非同分异构体,故⑥错误;
故选C.
点评 本题考查了物质分类、物质组成、物质名称、同位素、同素异形体、同分异构体等知识点,掌握基础是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 现有CO CO2 O3三种气体,它们分别都含有1摩尔O,则三种气体的物质的量之比3:2:1 | |
| B. | 5.6gCO和22.4L CO2中含有碳原子数一定相等 | |
| C. | 标况下,11.2升X气体分子质量为16g,则X气体的摩尔质量为32 | |
| D. | ngCl2中有m个Cl原子,则阿伏伽德罗常数NA的数值可以表示为 35.5m/n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4═2H++4SO2- | B. | CuSO4═Cu++SO4- | C. | Ba(OH)2═Ba2++2OH- | D. | FeCl3═Fe2++3Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
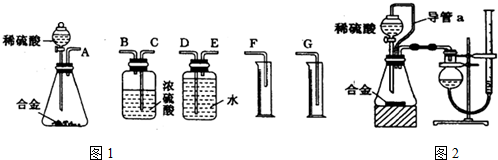
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
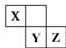 X、Y、Z 三种短周期元素在周期表中的位置如右图,X 通过共用三对电子形成 X2分子,下列说法不正确的是( )
X、Y、Z 三种短周期元素在周期表中的位置如右图,X 通过共用三对电子形成 X2分子,下列说法不正确的是( )| A. | 化合物 XZ3 中各原子均满足 8 电子的稳定结构 | |
| B. | X、Y、Z 三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z 单质可与 Y 的氢化物发生置换反应 | |
| D. | 一定条件下,X2与Al反应得到 AlX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
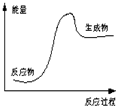
| A. | 该反应为吸热反应 | |
| B. | 该图可以表示石灰石高温分解 | |
| C. | 反应物比生成物稳定 | |
| D. | 因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
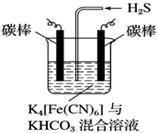 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.
铁及其化合物在工农业生产、环境保护等领域中有着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
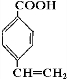 .
.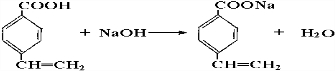 .
.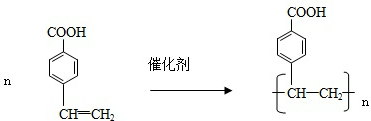 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com