
【题目】下列有关能量的判断或表示方法正确的是
A.相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多
B.从C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知相同条件下金刚石比石墨更稳定
C.由H+(aq)+OH-(aq)= H2O(l) △H=-57.3 kJ·mol-1,可知:含1 molCH3COOH的稀溶液与含1 molNaOH的稀溶液混合,放出的热量大于57.3 kJ
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则表示氢气燃烧的热化学方程式为:2H2(g)+O2(g)= 2 H2O(l) △H=-285.8 kJ·mol-1
【答案】A
【解析】
A、在相同条件下,将等量的硫蒸气和硫固体分别完全燃烧,硫固体转化为硫蒸气吸热,所以前者放出热量多,选项A正确;
B、由“C(s,石墨)=C(s,金刚石)△H=+1.9kJ/mol”可知,该反应为吸热反应,金刚石能量高于石墨,石墨比金刚石稳定,选项B错误;
C、醋酸是弱电解质,溶于水电离,电离吸热,则由H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量小于57.3 kJ,选项C错误;
D、2gH2完全燃烧生成液态水放出285.8kJ热量,2gH2即1molH2,则氢气燃烧的热化学方程式为:H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol,选项D错误;
O2(g)=H2O(l) △H=-285.8kJ/mol,选项D错误;
答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,水作为还原剂的是( )
A.2F2 + 2H2O = 4HF + O2B.Na2O + H2O = NaOH
C.Br2 + H2O ![]() HBr + HBrOD.2Na + 2H2O = 2NaOH + H2↑
HBr + HBrOD.2Na + 2H2O = 2NaOH + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知19.2gCu与过量的200mL5mol/L 稀硝酸充分反应,反应方程式如下:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)写出该反应的离子方程式:________;
(2)标准状况下,产生NO气体的体积为:________;转移电子的物质的量为______;反应后NO3-的物质的量浓度为:______。(忽略反应前后溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )
2NH3(g)(正反应为放热反应),673K、30MPa下,n(NH3)和n(H2)随时间 t变化的关系如图所示。下列叙述中,正确的是( )

A. 点a的正反应速率比点b的小
B. 点c处正反应速率和逆反应速率相等
C. 点d (t1时刻) 和点 e (t2时刻) 处n(N2)相同
D. 在t2时刻,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠( NaCl02)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等。已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2![]() 3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
3H2O,高于38 ℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。纯ClO2易分解爆炸。一种制备亚氯酸钠粗产品的工艺流程如下:
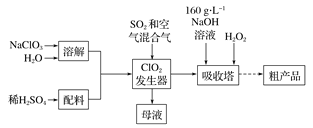
(1) ClO2发生器中的离子方程式为 ,发生器中鼓人空气的作用可能是__________(选填序号)。
a.将SO2氧化成SO3,增强酸性
b.稀释ClO2以防止爆炸
c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其原因是_____________。
(3)从“母液”中可回收的主要物质是 。
(4)从吸收塔中可获得NaCl02溶液,从NaCl02溶液到粗产品(NaClO2)经过的操作步骤依次为:①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥,得到成品。
(5)为测定粗品中NaCl02的质量分数,做如下实验:
准确称取所得亚氯酸钠样品10.00 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴人适量的稀硫酸,充分反应(ClO2-+ 4I-+ 4H+= 2H2O+ 2I2+ Cl-)。将所得混合液配成250mL待测溶液,取25.00 mL待测液,用2.000 mol.L-lNa2S203标准液滴定(I2+2S2O32-= 2I-+S4O62-),测得消耗Na2SO3溶液平均值为16.40mL。该样品中NaClO2的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。

根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为_________________________,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时,A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将______(填“正向”、“逆向”或“不”)移动。
④ 若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将________(填“正向”、“ 逆向”或“不移动”)。达到新平衡后,容器内温度________(填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元弱酸(用HA表示)在水中的电离方程式是HA![]() H++A-,回答下列问题:
H++A-,回答下列问题:
⑴ 向纯水中加入适量HA,水的电离平衡将向________(填“正”、“逆”)反应方向移动,理由是_______。
⑵ 若向⑴所得溶液中加入适量NaCl溶液,以上平衡将向________(填“正”、“逆”)反应方向移动,溶液中c(A-)将____________(填“增大”、“减小”或“不变”),溶液中c(OH-)将____________(填“增大”、“减小”或“不变”)。
⑶ 在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”),a_____0.01(填“大于”、“小于”或“等于”);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
)=c(Cl-),则溶液显________性(填“酸”、“碱”或“中”),a_____0.01(填“大于”、“小于”或“等于”);用含a的代数式表示NH3·H2O的电离常数Kb=_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用.以水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、A12O3、MnO等)制取钴产品的工艺流程如下:

已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、A13+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Mn(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程、Co2O3发生反应的离子方程式:_________________________。
(2)写出NaC1O3发生反应的主要离子方程式:______________________________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________________;萃取剂使用的最佳pH范围是__________(填代号)。
A.1.0~1.5 B.2.0~2.5 C.3.0~3.5 D.4.0~4.5

(5)“沉钴”时生成CoCO3的离子方程式为__________________________________。
(6)在空气中焙烧CoCO3生成CoxOy和CO2,测得充分煅烧后固体质量为4.82g,CO2的体积为1.344L(标准状况),则CoxOy的化学式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com