
【题目】硫、氮、磷等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为________。
(2)常见含硫的物质有![]() ,
,![]() ,
,![]() ,该三种物质中熔点最高的是________(填化学式)。
,该三种物质中熔点最高的是________(填化学式)。
(3)将过量的![]() 通入
通入![]() 溶液中可以得到
溶液中可以得到![]() ,
,![]() 中第一电离能最大的是________(填元素符号)。
中第一电离能最大的是________(填元素符号)。![]() 、
、![]() 和
和![]() 的价电子对数均为4,但键角不同,其原因是________。
的价电子对数均为4,但键角不同,其原因是________。
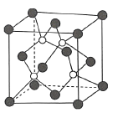
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应得到。磷化硼晶体的晶胞结构如图所示,该晶胞中含有________个B原子。已知该晶胞的边长为![]() ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为![]() ,则磷化硼晶体的密度为________
,则磷化硼晶体的密度为________![]() 。
。
【答案】1s22s22p63s13p33d1 ![]() N 中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小 4
N 中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小 4 ![]()
【解析】
(1)根据基态P的核外电子排布式分析书写;
(2)根据晶体类型分析判断;
(3)根据第一电离能的变化规律分析,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小;
(4)根据晶胞结构分析,P原子占据晶胞的顶点和面心,为面心立方最密堆积,B在晶胞内,根据ρ=![]() 计算晶体密度。
计算晶体密度。
(1)磷是15号元素,基态P原子的核外电子排布式为1s22s22p63s23p3,磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,该激发态原子的核外电子排布式为1s22s22p63s13p33d1。故答案为:1s22s22p63s13p33d1;
(2)![]() 和
和![]() 属于分子晶体,
属于分子晶体,![]() 属于离子晶体,离子键的强度远大于分子间作用力,该三种物质中熔点最高的是
属于离子晶体,离子键的强度远大于分子间作用力,该三种物质中熔点最高的是![]() 。故答案为:
。故答案为:![]() ;
;
(3)将过量的![]() 通入
通入![]() 溶液中可以得到
溶液中可以得到![]() ,
,![]() 中铜是金属,第一电离能最小,氮的2p轨道是半充满状态,能量较低,体系较稳定,而氧的2p却易失一个电子,变为半充满状态,第一电离能N大于O,O和S同主族,第一电离能O大于S,第一电离能S大于H,第一电离能最大的是N。
中铜是金属,第一电离能最小,氮的2p轨道是半充满状态,能量较低,体系较稳定,而氧的2p却易失一个电子,变为半充满状态,第一电离能N大于O,O和S同主族,第一电离能O大于S,第一电离能S大于H,第一电离能最大的是N。![]() 中心原子碳上没有孤电子对,键角最大,
中心原子碳上没有孤电子对,键角最大,![]() 中心原子氮上有一对孤电子对,键角略小,
中心原子氮上有一对孤电子对,键角略小,![]() 中心原子氧上有二对孤电子对,键角最小;
中心原子氧上有二对孤电子对,键角最小;![]() 、
、![]() 和
和![]() 的价电子对数均为4,但键角不同,其原因是中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小。故答案为:N;中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小;
的价电子对数均为4,但键角不同,其原因是中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小。故答案为:N;中心原子含有的孤电子对不同,孤电子对对成键电子对的斥力较大,孤电子对越多,键角越小;
(4)由磷化硼晶体的晶胞结构图可知,该晶胞中含有4个B原子,P原子占据晶胞的顶点和面心,一个晶胞中含有P的个数为8×![]() +6×
+6×![]() =4个,不妨取1mol这样的晶胞,则有NA个这样的晶胞,1mol晶胞的质量为42×4g,1mol晶胞的体积为NA·(a×10-10)3cm3,所以晶体密度为ρ=
=4个,不妨取1mol这样的晶胞,则有NA个这样的晶胞,1mol晶胞的质量为42×4g,1mol晶胞的体积为NA·(a×10-10)3cm3,所以晶体密度为ρ=![]() =
=![]() g·cm-3。故答案为:
g·cm-3。故答案为:![]() 。
。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】有机物X具有消炎功效,为测定其结构,某化学小组设计如下实验探究过程:
I. 确定X的分子式
(1)确定X的实验式。将有机物X的样品充分燃烧,对燃烧后的物质进行定量测量,所需装置及试剂如下所示:
A.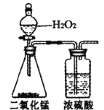 B.
B. C.
C. D.
D.
①装置的连接顺序是________。(填字母,部分装置可重复使用)
②取X样品6.9g,用连接好的装置进行实验,X样品充分燃烧后,测得B管增重15.4g,C管增重2.7g,则X的实验式为________。
(2)确定X的分子式。X的质谱图中分子离子峰对应的质荷比最大为138,则X的分子式为________。
Ⅱ. 确定的结构
(3)确定X的官能团。红外光谱图呈现,X中有O-H、C-O、C-C、苯环上的C-H、羧酸上的C=O等化学键以及邻二取代特征振动吸收峰,由此预测X含有的官能团有________(填名称)。
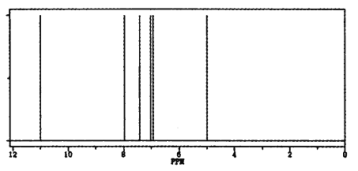
(4)确定X的结构式。核磁振动氢谱如下图所示,X的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.丙烯分子中所有原子有可能共平面
B.等质量的乙醇和乙烯完全燃烧生成CO2的质量不相等
C.甲醛(HCHO)和乙二醛(OHC—CHO)互为同系物
D.![]() 和
和![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的的是( )
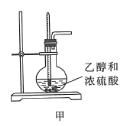
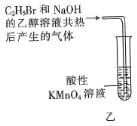
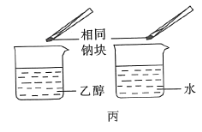
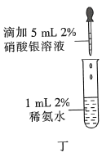
A.装置甲可用于实验室制备乙烯
B.操作乙可用于检验![]() 与
与![]() 的乙醇溶液反应生成的气体中含有乙烯
的乙醇溶液反应生成的气体中含有乙烯
C.操作丙可用于比较乙醇中羟基的氢原子和水分子中氢原子的活泼性
D.操作丁可用于配制银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明气孔的张开与保卫细胞膜上的H+—ATPase有着非常密切的关系。H+—ATPase被蓝光诱导激活后就会利用ATP水解释放的能量将H+分泌到细胞外,此时内向K+离子通道开启,细胞外的K+转移进保卫细胞;同时其他相关阴离子在H+协助下也进入保卫细胞,从而使气孔张开。气孔张开运动的相关机理如下图所示。
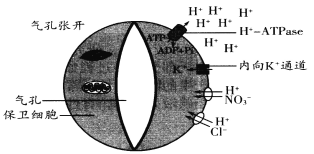
注:图中两个细胞贴近气孔部分细胞壁较厚,伸缩性较小,外侧较薄
(1)保卫细胞膜上的H+—ATPase被激活时,细胞内的H+通过____________的方式转移出保卫细胞;据细胞吸水与失水的原理推测,蓝光诱导后气孔张开的原因是__________________。
(2)植物有时为防止水分过度散失气孔会关闭,此时叶肉细胞仍可进行光合作用,消耗的CO2可来自___________和___________,但光合速率会明显减慢;气孔开启瞬间植物叶肉细胞消耗C5的速率会___________(填“增大”或“减小”或“不变”)。
(3)科研人员利用转基因技术在拟南芥保卫细胞中表达了由光控制的K+通道蛋白BL,试图提高气孔动力,即光照增强时气孔打开的更快,光照减弱时关闭的也更快。
①欲探究BL蛋白是否发挥了此功能,可在变化的光照强度和恒定光照强度下,分别测正常植株和转基因植株的气孔动力,该实验的自变量是_____________________。
②若实验表明BL蛋白发挥了预期的作用,而在恒定光照强度下生长的转基因株系生物量积累和用水效率方面,与正常植株无明显差异,说明____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=![]() +4
+4![]() +2H2O
+2H2O
B.浓盐酸与MnO2反应制取Cl2:MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
C.酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2=2I2+2H2O
D.向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:![]() +OH-=
+OH-=![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。
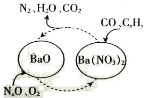
若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________。从最终排放的气体来看,氮元素将_______________________(填“被氧化”或“被还原”)。
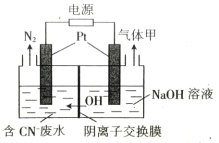
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________(填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________。
(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO![]() N2+2CO2 ΔH
N2+2CO2 ΔH
化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=_________________kJ/mol
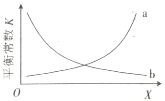
②该反应的平衡常数与外界因素X[代表温度、压强、![]() 或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
或催化剂接触面积]的关系如图所示。X是________________,能正确表达平衡常数K随X变化的曲线是________________(填“a”或“b”)。
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)![]() 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________;
②v(NO)=_______________;
③NH3的平衡转化率为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如表:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nsnnpn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 原子最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)E元素在周期表中的位置是_________________________。
(2)写出D元素基态原子的简化电子排布式:__________。
(3)这5种元素中电负性最大的元素是__________(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________________(填元素符号)。
(4)B、C、D的简单离子的半径由大到小的顺序为____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】布洛芬具有降温和抑制肺部炎症的双重作用。一种制备布洛芬的合成路线如图:
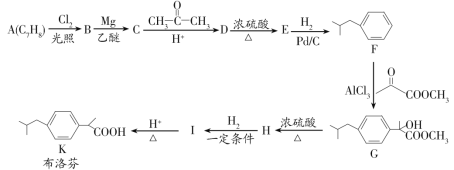
已知:①CH3CH2Cl![]() CH3CH2MgCl
CH3CH2MgCl
②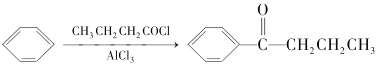 +HCl
+HCl
回答下列问题:
(1)A的化学名称为___,G→H的反应类型为___,H中官能团的名称为__。
(2)分子中所有碳原子可能在同一个平面上的E的结构简式为__。
(3)I→K的化学方程式为___。
(4)写出符合下列条件的D的同分异构体的结构简式__(不考虑立体异构)。
①能与FeCl3溶液发生显色反应;②分子中有一个手性碳原子;③核磁共振氢谱有七组峰。
(5)写出以间二甲苯、CH3COCl和(CH3)2CHMgCl为原料制备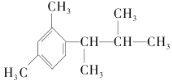 的合成路线:__(无机试剂任选)。
的合成路线:__(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com